
María Paula Lorenzo
GENERALIDADES Y CLASIFICACIÓN DEL MÚSCULO.
El tejido muscular tiene a su cargo el movimiento del cuerpo y de sus partes, y los cambios en el tamaño
y la forma de los órganos internos. Este tejido se caracteriza por cúmulos de células alargadas
especializadas dispuestas en haces paralelos que cumplen la función principal de
contracción.
La interacción del miofilamento es la causa de la contracción de las células musculares.
Dos tipos de
miofilamentos están asociados con la contracción celular.
• Filamentos delgados (6 nm a 8 nm de diámetro, 1,0 mm de largo) están compuestos
principalmente por la proteína
actina. Cada filamento delgado de actina filamentosa (actina F)
es un polímero formado sobre todo por moléculas de actina globular (
actina G).
• Filamentos gruesos (~15 nm de diámetro, 1,5 mm de largo) están compuestos principalmente
por la proteína
miosina II. Cada filamento grueso consiste en 200 a 300 moléculas de miosina II.
Las largas porciones de la cola en forma de varilla de cada molécula se aglomeran de manera
regular paralela pero escalonada, mientras que las partes correspondientes a las cabezas se
proyectan hacia fuera según un patrón helicoidal regular.
Los dos tipos de miofilamentos ocupan la mayor parte del volumen citoplasmático, que en las células
musculares también recibe el nombre de
sarcoplasma (gr. sarcos, carne; plássein, formar). La actina y la
miosina también están presentes en la mayoría de los otros tipos celulares (aunque en cantidades
considerablemente menores), donde cumplen una función en las actividades celulares como la citocinesis,
la exocitosis y la migración celular. En cambio, las células musculares contienen una gran cantidad de
filamentos contráctiles alineados que utilizan con el único propósito de producir trabajo mecánico.

María Paula Lorenzo
El músculo se clasifica de acuerdo con el aspecto de las células contráctiles.
Se reconocen dos tipos principales de músculo:
• músculo estriado, en el cual las células exhiben estriaciones transversales visibles con el
microscopio electrónico y
• músculo liso, en el cual las células no exhiben estriaciones transversales.
El tejido muscular estriado puede, además, subclasificarse según su ubicación:
• El músculo esquelético se fija al hueso y es responsable por el movimiento de los esqueletos
axial y apendicular y del mantenimiento de la posición y postura corporal. Además, los músculos
esqueléticos del ojo (músculos oculares extrínsecos) ejecutan el movimiento ocular preciso.
• El músculo estriado visceral es morfológicamente idéntico al músculo esquelético pero está
restringido a los tejidos blandos, a saber, la lengua, la faringe, la parte lumbar del diafragma y la
parte superior del esófago. Estos músculos tienen un rol esencial en el habla, la respiración y la
deglución.
• El músculo cardíaco es un tipo de músculo estriado que se encuentra en la pared del corazón y
en la desembocadura de las venas grandes que llegan a este órgano.
Las estriaciones transversales en el músculo estriado se producen en gran parte por una disposición
intracitoplasmática específica de los miofilamentos delgados y gruesos. Esta disposición es la misma en
todos los tipos de células musculares estriadas. Las diferencias principales entre las células musculares
esqueléticas y las células musculares cardíacas están en su tamaño, forma y organización relativa entre
ellas.
Las células musculares lisas no exhiben estriaciones transversales debido a que los miofilamentos no
alcanzan el mismo grado de orden en su distribución. Además, los miofilamentos que contienen miosina
en el músculo liso son muy lábiles. El músculo liso se limita a las vísceras y al sistema vascular, a los
músculos erectores del pelo en la piel y a los músculos intrínsecos del ojo.
Una célula del músculo esquelético es un sincitio multinucleado.
En el músculo esquelético, cada célula muscular, más comúnmente llamada
fibra muscular, es en realidad
un
sincitio multinucleado. Una fibra muscular se forma durante el desarrollo por la fusión de pequeñas
células musculares individuales denominadas
mioblastos. Cuando se observa en un corte transversal, la
fibra muscular multinucleada madura revela una forma poligonal con un diámetro de 10 μm a 100 μm. Su
longitud varía desde casi un metro, como en el músculo sartorio del miembro inferior, hasta unos pocos
milímetros, como en el músculo estapedio del oído medio.
(Nota: no debe confundirse una fibra muscular con una fibra del tejido conjuntivo; las fibras musculares son células del músculo
esquelético, mientras que las fibras del tejido conjuntivo son productos extracelulares de las células de este tejido.)
Los núcleos de la fibra muscular esquelética están ubicados en el citoplasma justo debajo de la membrana
plasmática, también denominada
sarcolema, que está compuesto por la membrana plasmática de la
célula muscular, su lámina externa y la lámina reticular que la rodea.
El músculo esquelético consiste en fibras musculares estriadas que se mantienen juntas por el tejido
conjuntivo.
El tejido conjuntivo que rodea tanto a las fibras musculares individuales como a los haces de fibras
musculares, es imprescindible para la transducción de fuerzas (fig. 11-2). En el extremo del músculo, el
tejido conjuntivo continúa en la forma de un tendón o alguna otra estructura de fibras de colágeno que
sirve para fijarlos, por lo general, a huesos. En el tejido conjuntivo hay abundancia de vasos sanguíneos y
nervios.
El tejido conjuntivo asociado con músculo se designa de acuerdo con su relación con las fibras musculares:
• El endomisio es una capa delicada de fibras reticulares que rodea inmediatamente las fibras
musculares individuales. En el endomisio sólo se encuentran vasos sanguíneos de pequeño
MÚSCULO ESQUELÉTICO
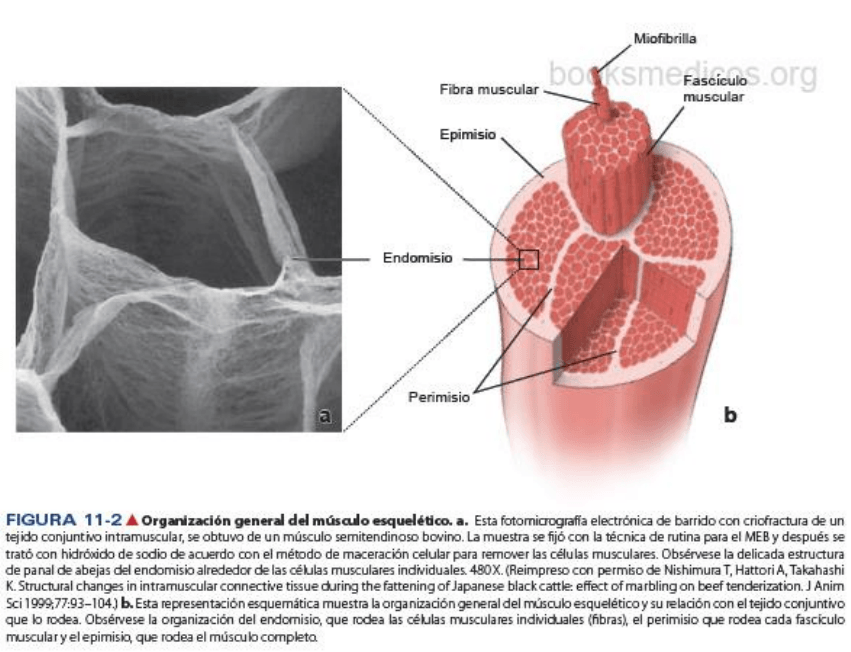
María Paula Lorenzo
calibre y ramificaciones nerviosas muy finas, que transcurren en forma paralela a las fibras
musculares.
• El perimisio es una capa de tejido conjuntivo más gruesa que rodea un grupo de fibras para
formar un
haz o fascículo. Los fascículos son unidades funcionales de fibras musculares que
tienden a trabajar en conjunto para realizar una función específica. El perimisio presenta vasos
sanguíneos grandes y nervios.
• El epimisio es la vaina de tejido conjuntivo denso que rodea todo el conjunto de fascículos que
constituyen el músculo. Los principales componentes de la irrigación y la inervación del músculo
penetran el epimisio.
De acuerdo con su color in vivo, se identifican tres tipos de fibras musculares esqueléticas: rojas, blancas
e intermedias.
Desde hace mucho tiempo se sabe que las fibras musculares esqueléticas in vivo difieren en su diámetro
y en su color natural. Las diferencias de color no se observan en los cortes teñidos con hematoxilina y
eosina (H&E). Sin embargo, las reacciones histoquímicas basadas en la actividad enzimática oxidativa,
específicamente las reacciones de la
succínico deshidrogenasa y de la nicotinamida adenina
dinucleótido–tetrazolio (NADH-TR)
, confirman las observaciones en el tejido en fresco y revelan varios
tipos de fibras musculares esqueléticas. La nomenclatura más obvia para describir estas diferencias es la
división en fibras rojas, blancas e intermedias.
Las fibras musculares esqueléticas se caracterizan por la rapidez de contracción, la velocidad enzimática
y la actividad metabólica.
La clasificación actual de las fibras musculares esqueléticas se basa en la
rapidez de contracción y la
velocidad enzimática de la reacción de la ATPasa miosínica de las fibras y el perfil metabólico. La rapidez
de contracción determina la celeridad con la que la fibra puede contraerse y relajarse. La velocidad de
reacción de la ATPasa de la miosina determina el ritmo con el que esta enzima es capaz de escindir
moléculas de ATP durante el ciclo contráctil. El
perfil metabólico indica la capacidad para producir ATP
mediante la fosforilación oxidativa o la glucólisis. Las fibras caracterizadas por un metabolismo oxidativo
contienen grandes cantidades de mioglobina y una mayor cantidad de mitocondrias, con sus complejos
constitutivos de citocromos transportadores de electrones. La mioglobina es una pequeña proteína

María Paula Lorenzo
globular fijadora de oxígeno, de 17,8 kDa, que contiene una forma ferrosa de
hierro (𝐹𝑒
+2
). Es muy semejante a la hemoglobina de los eritrocitos y se
encuentra en cantidades variables en las fibras musculares. La función principal
de la mioglobina es almacenar oxígeno en las fibras musculares, lo que
proporciona una fuente eficaz para el metabolismo muscular.
Las lesiones
traumáticas producidas en el sistema osteomuscular (p. ej., lesiones por
accidentes) causan la degradación (rabdomiólisis) y la liberación de mioglobina
desde las células musculares lesionadas hacia la circulación. La mioglobina es
eliminada de
la circulación por los riñones. Sin embargo, grandes cantidades de
mioglobina son tóxicas para el epitelio tubular renal, lo que puede causar una
insuficiencia renal aguda. La detección de mioglobina en la sangre es una
prueba sensible pero no
específica para la lesión muscular.
Los tres tipos de fibras musculares esqueléticas son las fibras tipo I (oxidativas
lentas), las fibras tipo IIa (glucolíticas oxidativas rápidas) y las fibras tipo IIb
(glucolíticas rápidas).
Es común que en cualquier músculo esquelético dado se encuentren tres tipos
de fibras; la proporción de cada tipo de fibra varía según la actividad funcional
del músculo.
• Las fibras tipo I o fibras oxidativas lentas son fibras pequeñas que
aparecen rojas en los especímenes frescos y contienen muchas mitocondrias y
grandes cantidades de mioglobina y complejos de citocromo. Su concentración
elevada de enzimas oxidativas mitocondriales se demuestra por la gran
intensidad de tinción con las reacciones histoquímicas de la succínico
deshidrogenasa y de la NADH-TR, como ya se describió. Las fibras tipo I son
unidades motoras de contracción lenta resistentes a la fatiga. Estas fibras tienen gran
resistencia a la fatiga, aunque generan menos tensión que las otras fibras. La velocidad de
reacción de la ATPasa miosínica es la más lenta de todas entre los tres tipos de fibras. Las fibras
tipo I son típicas de los músculos de las extremidades de los mamíferos y del músculo pectoral
de las aves migratorias.
Más importante aún es que son las fibras principales de los músculos largos erectores de la
columna en el dorso de los seres humanos, donde se adaptan particularmente a las
contracciones prolongadas y lentas necesarias para mantener la postura erecta. Un alto
porcentaje de estas fibras constituyen los músculos de los atletas de alta resistencia, como los
corredores de maratones.
• Las fibras tipo IIa o fibras glucolíticas oxidativas rápidas son las fibras
intermedias que se observan en el tejido fresco. Son de un tamaño
mediano con muchas mitocondrias y un contenido alto de hemoglobina. A
diferencia de las fibras tipo I, las fibras tipo IIa contienen grandes
cantidades de glucógeno y son capaces de realizar la glucolisis anaeróbica.
Constituyen las unidades motoras de contracción rápida resistentes a la
fatiga
, que generan un gran pico de tensión muscular. Entre los atletas que
tienen un alto porcentaje de estas fibras glucolíticas oxidativas rápidas, se
encuentran los corredores de 400 m y 800 m, los nadadores de distancias
medias y los jugadores de hockey.
• Las fibras tipo IIb o fibras glucolíticas rápidas son fibras grandes que
se ven de color rosa pálido en los especímenes en estado fresco y contienen
menos mioglobina y menor cantidad de mitocondrias que las fibras de tipo
I y de tipo IIa. Tienen una baja concentración de enzimas oxidativas pero
exhiben una actividad enzimática anaeróbica alta y almacenan una
cantidad considerable de glucógeno. Estas fibras integran las
unidades
motoras de contracción rápida propensas a la fatiga
y generan un gran
pico de tensión muscular. Su velocidad de reacción de ATPasa miosínica es
la más rápida de todos los tipos de fibras. También se fatigan rápidamente
a causa de la producción de ácido láctico.
Por lo tanto, las fibras tipo IIb
están adaptadas para la contracción rápida y los movimientos finos y

María Paula Lorenzo
precisos. Constituyen la mayor parte de las fibras de los músculos extrínsecos del ojo y los
músculos que controlan los movimientos de los dedos. Estos músculos tienen una cantidad
mayor de uniones neuromusculares que las fibras tipo I, lo que permite un control nervioso más
preciso de los movimientos en estos músculos. Los corredores de distancias cortas, los
levantadores de pesas y otros atletas de campo tienen un elevado porcentaje de fibras tipo IIb.
Miofibrillas y miofilamentos
La subunidad estructural y funcional de la fibra muscular es la miofibrilla.
Una
fibra muscular está repleta de subunidades estructurales dispuestas longitudinalmente denominadas
miofibrillas. Las miofibrillas son visibles en los preparados histológicos favorables y se ven mejor en los
cortes transversales de las fibras musculares. En estos cortes, le imparten a la fibra un aspecto punteado.
Las miofibrillas se extienden a lo largo de toda la célula muscular.
Las miofibrillas están compuestas por haces de miofilamentos.
Los
miofilamentos son polímeros filamentosos individuales de miosina II (filamentos gruesos) y de activa
y sus proteínas asociadas (filamentos delgados). Los miofilamentos son los verdaderos elementos
contráctiles del músculo estriado. Los haces de miofilamentos que componen la miofibrilla están
rodeados por un retículo endoplásmico liso (REL) bien desarrollado, también denominado retículo
sarcoplásmico.
Este retículo forma una red tubular muy bien organizada alrededor de los elementos
contráctiles en todas las células musculares estriadas. Las mitocondrias y los depósitos de glucógeno se
localizan entre las miofibrillas en asociación con el REL.
Las estriaciones transversales son la principal característica histológica del músculo estriado.
Las estriaciones transversales son evidentes en los preparados de cortes longitudinales de fibras
musculares teñidas con H&E. También pueden verse en preparados de fibras musculares vivas sin tinción,
examinadas con los microscopios de contraste de fase o de polarización, en los cuales aparecen como
bandas claras y oscuras alternadas. Estas bandas se denominan
banda A y banda I.

María Paula Lorenzo
En el microscopio de polarización, las bandas oscuras son
birrefringentes (es decir, alteran la luz polarizada en dos planos). Por lo
tanto, las bandas oscuras, al ser doblemente refráctiles, son
anisotrópicas y reciben el nombre de banda A. Las bandas claras son
monorrefringentes (es decir, no alteran el plano de luz polarizada). Por
consiguiente, son
isotrópicas y reciben el nombre de banda I.
Tanto las bandas A como las bandas I están divididas en dos partes por
regiones estrechas de densidad contrastante. La banda I clara está
dividida en dos por una línea densa, la
línea Z, también llamada disco Z
(del alemán zwischenscheibe, disco intermedio). La banda A oscura está
dividida por una región menos densa, o clara, denominada
banda H [del
alemán hell, luz]. Además, en la mitad de la banda H clara se observa una
fina línea densa denominada línea M [del alemán mitte, medio]. La línea
M se demuestra mejor en las fotomicrografías electrónicas, aunque en
preparados óptimos teñidos con H&E se puede detectar con el
microscopio óptico.
Como ya se mencionó, el patrón de bandas transversales del músculo
estriado se debe a la disposición de los dos tipos de miofilamentos. Para
comprender el mecanismo de contracción, este patrón de bandas debe
considerarse en términos funcionales.
La unidad funcional de la miofibrilla es el sarcómero, el segmento de
la miofibrilla ubicado entre dos líneas Z adyacentes.
El
sarcómero es la unidad contráctil básica del músculo estriado. Es la
porción de una miofibrilla entre dos líneas Z adyacentes. Un sarcómero
mide de 2 μm a 3 μm en el músculo relajado de un mamífero. Puede
distenderse a más de 4 μm y durante la contracción extrema puede
reducirse hasta a 1 μm. La célula muscular completa exhibe estriaciones
transversales debido a que los sarcómeros de las miofibrillas contiguas
están “en registro” (es decir, hay una coincidencia precisa entre las
bandas de una miofibrilla y la de sus vecinas).
La disposición de filamentos gruesos y delgados origina las diferencias
de densidad que producen las estriaciones transversales de las miofibrillas.
Los
filamentos gruesos que contienen miosina tienen un largo aproximado de 1,6 m y están restringidos
a la porción central del sarcómero (es decir, la banda A). Los
filamentos delgados que contienen actina
se fijan a la línea Z y se extienden dentro de la línea A hacia el borde de la banda H. Las porciones de dos
sarcómeros, en cada lado de la línea Z, constituyen la banda I y contienen sólo filamentos delgados. En un
corte longitudinal de un sarcómero, la línea Z aparece como una estructura de zigzag, con material de
matriz, llamado matriz del disco Z, que divide a la mitad la línea zigzagueante. La línea Z y su material de
matriz sujetan los filamentos delgados de sarcómeros contiguos a los ángulos del zigzag a través de la
a-
actinina, una proteína fijadora de actina. La matriz Z incluye una gran cantidad de proteínas (p. ej.,
teletonina, talina, desmina, miotilina, filamina C) que sujetan las líneas Z a las miofibrillas vecinas y a la
membrana celular contigua.
El filamento delgado consiste principalmente en moléculas de actina polimerizadas acopladas con
proteínas reguladoras y otras proteínas asociadas al filamento delgado que se enroscan juntas.
Un
filamento delgado normal tiene un diámetro de 5 nm a 6 nm y consiste en una hélice de doble hebra
de monómeros de actina polimerizada. Cada filamento delgado está calibrado a aproximadamente 1,0
μm a 1,3 μm de longitud, según el tipo muscular. Las dos proteínas reguladoras importantes en los
músculos estriados, la tropomiosina y la troponina, se enroscan con dos hebras de actina. Otras proteínas
asociadas al filamento delgado incluyen la tropomodulina y la nebulina.
• La actina G es una molécula pequeña de 42 kDa que se polimeriza para formar una hélice de
doble hebra, llamado filamento de actina F. Estos filamentos de actina son polares. Todas las

María Paula Lorenzo
moléculas de actina G están orientadas en la misma dirección. El extremo positivo (barbado) de
cada filamento está unido a la línea Z por la a-actinina con la asistencia de la nebulina. El extremo
negativo (puntiagudo) se extiende hacia la línea M y está protegido por la tropomodulina, una
proteína formadora de casquetes. Cada molécula de actina G del filamento delgado tiene un sitio
de unión para la miosina, la cual en una etapa de reposo está protegida por la molécula de
tropomiosina.
• La tropomiosina es una proteína de 64 kDa que también consiste en una doble hélice de dos
polipéptidos. Forma filamentos que se ubican en el surco que hay entre las moléculas de actina
F en el filamento delgado. En el músculo en reposo, la tropomiosina y su proteína reguladora, el
complejo de troponina, ocultan el sitio de unión a la miosina que hay en la molécula de actina.
• La troponina consiste en un complejo de tres subunidades
globulares. Cada molécula de tropomiosina contiene un
complejo de troponina. La troponina C (TnC) es la subunidad
más pequeña del complejo de troponina (18 kDa). Fija 𝐶𝑎
+2
, un
fenómeno esencial para el inicio de la contracción. La troponina
T (TnT), una subunidad de 30 kDa, se une a la tropomiosina, que
fija el complejo de troponina. La troponina I (TnI), también una
subunidad de 30 kDa, se fija a la actina e inhibe, así, la
interacción entre la miosina y la actina. Las subunidades TnT y
TnI se unen para formar un brazo IT asimétrico, que es visible
en una reconstrucción tridimensional del complejo de
troponina.
• La tropomodulina es una proteína de fijadora de actina de ~40
kDa que se une al extremo libre (negativo) del filamento
delgado. Esta proteína formadora de casquetes de actina,
mantiene y regula la longitud del filamento de actina en el
sarcómero. Las variaciones en la longitud del filamento delgado
(como aquellas en las fibras musculares tipo I y tipo IIb) afectan
la relación tensión- longitud durante la contracción muscular y,
por lo tanto, influye sobre las propiedades fisiológicas del
músculo.
• La nebulina es una proteína alargada, no elástica, de 600 kDa
unida a las líneas Z, que abarca la mayor parte del filamento
delgado, excepto por su extremo negativo puntiagudo. La
nebulina actúa como una “regla molecular” para la longitud del
filamento delgado debido a que el peso molecular de las
diferentes isoformas de nebulina se correlaciona con la longitud
de los filamentos delgados durante el desarrollo muscular.
Además, la nebulina añade estabilidad a los filamentos delgados
sujetos por la a-actinina a las líneas Z.
El filamento grueso está compuesto principalmente por moléculas de miosina.
El componente principal de los
filamentos gruesos es la miosina II, un miembro de la superfamilia miosina
de proteínas motoras que produce motilidad por la interacción cíclica con las subunidades de actina en el
músculo estriado. Este ciclo de puentes transversales de actomiosina hace que los filamentos gruesos y
delgados se deslicen uno sobre otro, produciendo movimiento.
La
miosina II, una proteína motora larga asociada a actina, con forma de varilla, de 510 kDa, es un dímero
compuesto por dos
cadenas polipeptídicas pesadas (222 kDa cada una) y cuatro cadenas ligeras. La
miosina tiene dos cabezas globulares (región S1) conectadas por brazos de palanca (región S2) con una
larga cola . Cada monómero de miosina contiene una cadena ligera esencial (ELC) de 18 kDa y una cadena
ligera reguladora (RLC)
de 2 kDa, que se envuelven alrededor del brazo de palanca justo debajo de la
cabeza de miosina. La cadena ligera reguladora estabiliza el brazo de palanca. La interacción entre las
cadenas pesadas y ligeras determina la velocidad y la fuerza de la contracción muscular. Cada cabeza

María Paula Lorenzo
globular representa un
dominio motor de cadena pesada que se proyecta en un ángulo aproximadamente
recto en uno de los extremos de la molécula de miosina. La cabeza de miosina tiene
dos sitios de unión
específicos
, uno para el ATP con la actividad ATPasa y otro para la actina. La digestión enzimática de la
miosina produce dos fragmentos, una meromiosina pesada (HMM) y otra meromiosina ligera (LMM). La
HMM está formada por las cabezas, los brazos de palanca y ambos pares de cadenas ligeras, mientras que
la LMM está formada por la cola. Las moléculas de miosina en el músculo estriado, se agrupan cola con
cola para formar
filamentos gruesos bipolares de miosina. Los segmentos de la cola se superponen de
modo tal que las cabezas globulares se proyectan desde el filamento grueso. La “zona desnuda” en el
medio del filamento no presenta proyecciones globulares. Los filamentos gruesos están conectados entre
sí en sus zonas desnudas por una familia de proteínas de la línea M.
Las proteínas accesorias mantienen la alineación precisa de los filamentos delgados y gruesos dentro
del sarcómero.
Para mantener la eficiencia y la velocidad de la contracción
muscular, tanto los filamentos delgados como los gruesos en cada
miofibrilla, deben estar alineados en forma precisa y mantener una
distancia óptima unos de otros. Las proteínas conocidas como
proteínas accesorias son imprescindibles para la regulación del
espaciado, la fijación y el alineamiento de los miofilamentos. Estos
componentes estructurales proteicos de las fibrillas musculares
esqueléticas, representan menos del 25 % de las proteínas totales
de la fibra muscular.
Estas proteínas incluyen las siguientes:
• Titina, una proteína gigante (2 500 kDa) que abarca la mitad
del sarcómero. La titina se extiende desde la línea Z y el filamento
delgado en su terminal N hacia el filamento grueso y la línea M en
su terminal C. Entre los filamentos gruesos y delgados, dos porciones
con forma de resorte de esta proteína, contribuyen a centrar el
filamento grueso en el medio de las dos líneas Z. Debido a la
presencia de los “resortes” moleculares, la titina impide el
estiramiento excesivo del sarcómero al desarrollar una fuerza de
recuperación pasiva que colabora con su acortamiento.
• α-actinina, una proteína fijadora de actina, bipolar, corta, de 190 kDa y con forma de varilla, que
organiza los filamentos delgados en disposiciones paralelas y los fija en la línea Z. Además, forma
enlaces transversales con la terminal N de la titina incluida en la línea Z.
• Desmina, un tipo de filamento intermedio de 53 kDa, que forma una malla alrededor del
sarcómero a la altura de las líneas Z, con lo que une estos discos entre sí y a la membrana
plasmática a través de la unión con la proteína anquirina y forma enlaces cruzados
estabilizadores entre las miofibrillas vecinas.
• Proteínas de la línea M, comprenden varias proteínas fijadoras de miosina que mantienen los
filamentos gruesos en registro en la línea M y adhieren las moléculas de titina a los filamentos
gruesos. Las proteínas de la línea M incluyen
miomesina (185 kDa), proteína M (165 kDa),
oscurina (700 kDa) y una creatina fosfatasa muscular (MM-CK) de 81 kDa.
• Proteína C fijadora de miosina (MyBP-C), una proteína de 140 kDa a 150 kDa, que contribuye al
armado y estabilización normales de los filamentos gruesos. Forma varias rayas transversales
bien definidas en ambos lados de la línea M, que interacciona con las moléculas de titina.
• Distrofina, se cree que esta proteína grande de 427 kDa vincula la laminina, que reside en la
lámina externa de la célula muscular, con los filamentos de actina.
La falta de esta proteína está
asociada con la debilidad muscular progresiva, un trastorno de origen genético conocido como
distrofia muscular de Duchenne. La distrofina es codificada en el cromosoma X, lo cual explica
por qué sólo los varones sufren la distrofia muscular de Duchenne. La identificación reciente del
gen de la distrofina y sus productos, ha sido de gran relevancia clínica.

María Paula Lorenzo
Cuando un músculo se contrae, cada sarcómero se acorta, pero la
longitud de los miofilamentos no se modifica.
Durante la contracción, el sarcómero y la banda I se acortan, mientras
que la banda A permanece con la misma longitud. Para mantener los
miofilamentos en una longitud constante, el acortamiento del
sarcómero debe ser causado por un incremento en la superposición
de los filamentos gruesos y delgados. Esta superposición es bien
visible al comparar fotomicrografías electrónicas de músculo
contraído y músculo relajado. La banda H se estrecha, y los filamentos
delgados penetran la banda H durante la contracción. Estas
observaciones indican que los filamentos delgados se deslizan sobre
los filamentos gruesos durante la contracción.
Ciclo de los puentes transversales de actomiosina
Cuando el músculo está relajado, la tropomiosina impide que las
cabezas de miosina se unan con las moléculas de actina porque cubre
los sitios de unión a miosina en las moléculas de actina. Después de la
estimulación nerviosa, se libera 𝐶𝑎
+2
en el sarcoplasma, que se une a
la troponina, la que entonces actúa sobre la tropomiosina para
exponer los sitios de unión a la miosina en las moléculas de actina.
Una vez que los sitios de unión están expuestos, las cabezas de
miosina son capaces de interactuar con las moléculas de actina y de
formar puentes transversales, y los dos filamentos se deslizan uno
sobre el otro.
El acortamiento de un músculo comprende rápidas interacciones
repetidas entre las moléculas de actina y miosina que mueven los
filamentos delgados junto con los filamentos gruesos.
El ciclo de los puentes transversales en el músculo esquelético recibe
el nombre de
ciclo de los puentes transversales de actomiosina y suele
describirse como una serie de fenómenos
bioquímicos y mecánicos
acoplados. La miosina, como
proteína motora asociada a la actina con
actividad ATPasa,
convierte la energía química en fuerza mecánica al
accionar
en forma cíclica con los estados de actina adherida y actina no adherida durante su ciclo de
actividad ATPasa. Cada ciclo de
puentes transversales se compone de cinco etapas: adhesión, separación,
flexión, generación de fuerza y re-adhesión. En
los músculos cardíacos o lisos, la duración relativa de las
etapas
individuales, puede alterarse por los cambios en la composición molecular de las moléculas de la
miosina específica
del tejido. Sin embargo, se cree que el ciclo básico es el mismo para todas las
interacciones entre miosina y actina.
La adhesión es la etapa inicial del ciclo; la cabeza de miosina está fuertemente unida a la molécula de
actina del filamento delgado.
En el comienzo del ciclo de los puentes transversales, la cabeza de miosina está fuertemente unida a la
molécula de actina del filamento delgado, y el ATP está ausente. La posición de la cabeza de la miosina en
esta etapa tiene una
conformación erguida u original. Esta disposición de muy corta duración es conocida
como configuración de rigidez.
El endurecimiento y la rigidez muscular que comienza en el momento de
la muerte son causados por la falta de ATP y se
conoce como rigidez cadavérica (rigor mortis). En un
músculo en contracción activa, esta etapa culmina con la fijación de ATP a la cabeza de la miosina.
La separación es la segunda etapa del ciclo. La cabeza de la miosina se desacopla del filamento delgado.
En esta etapa del ciclo de los puentes transversales, el ATP se une a la cabeza de la miosina e induce
cambios de conformación del sitio de unión a la actina. Esto reduce la afinidad de la cabeza de la miosina
por la molécula de la actina del filamento delgado y determina que la cabeza de la miosina se desacople
del filamento delgado.
La flexión es la tercera etapa del ciclo y “reinicia” el motor de la miosina; la cabeza de la miosina, como
resultado de la hidrólisis del ATP, asume su posición previa al golpe de fuerza.

María Paula Lorenzo
El sitio de fijación de ATP de la cabeza de la miosina sufre cambios de conformación adicionales, que hacen
que ésta se flexione al rotar el brazo de palanca de la miosina para asumir su posición previa al golpe de
fuerza. Este movimiento se inicia con la escisión del ATP en adenosina difosfato (ADP) y fosfato inorgánico
(Pi). Ambos productos, no obstante, permanecen unidos a la cabeza de la miosina. En esta etapa del ciclo,
el desplazamiento lineal de la cabeza de miosina en relación con el filamento delgado es de unos 5 nm.
A veces, esta etapa se denomina
“golpe de recuperación.”
La generación de fuerza es la cuarta etapa del ciclo. La cabeza de la miosina libera el fosfato inorgánico
y se produce el golpe de fuerza.
La cabeza de la miosina se fija débilmente al sitio de unión en la nueva molécula de actina del filamento
delgado, lo que causa la liberación del fosfato inorgánico. Esta liberación tiene dos efectos. Primero, se

María Paula Lorenzo
incrementa la afinidad de fijación entre la cabeza de la miosina y su nuevo sitio de unión. Segundo, la
cabeza de la miosina genera una fuerza a medida que retorna a su posición erguida original. Por lo tanto,
a medida que la cabeza de la miosina se endereza, impulsa el movimiento del filamento delgado a lo largo
del filamento grueso. Este es el “
golpe de fuerza” del ciclo. Durante esta etapa, se pierde el ADP de la
cabeza de la miosina.
La re-adhesión es la quinta y última etapa del ciclo; la cabeza de la miosina se une en forma estrecha a
una nueva molécula de actina.
La cabeza de la miosina otra vez se une en forma estrecha a la nueva molécula de actina del filamento
delgado (configuración de rigidez) y el ciclo puede repetirse.
Las dos cabezas de la molécula de miosina trabajan juntas de un modo productivo y coordinado. Aunque
una cabeza de miosina individual se separe del filamento delgado durante el ciclo, las cabezas de otras
miosinas del mismo filamento grueso se adherirán a las moléculas de actina, lo cual genera el movimiento.
Dado que las cabezas de miosina se disponen en forma de imágenes especulares a cada lado de la banda
H (organización antiparalela), esta acción arrastra los filamentos delgados hacia la banda A, con lo que se
acorta el sarcómero.
Regulación de la contracción muscular
En la regulación de la contracción muscular participan el 𝑪𝒂
+𝟐
, el retículo sarcoplásmico y el sistema de
túbulos transversos.
El 𝐶𝑎
+2
debe estar disponible para la reacción entre la actina y la miosina. Después de la contracción, el
𝐶𝑎
+2
debe eliminarse. El envío y la eliminación rápidos de 𝐶𝑎
+2
se logra por el trabajo combinado del
retículo sarcoplásmico y el sistema de túbulos transversos.
El
retículo sarcoplásmico forma un compartimento membranoso de cisternas aplanadas y conductos
anastomosados que sirven como reservorios de iones de calcio. Está organizado como una serie de redes
repetidas alrededor de las miofibrillas. Cada red del retículo se extiende desde una unión A-I hasta la
siguiente dentro de un sarcómero. La red contigua del retículo sarcoplásmico continúa desde la unión

María Paula Lorenzo
A-I hasta la siguiente del sarcómero vecino. Por lo tanto, una red del
retículo sarcoplásmico rodea la banda A y la red contigua rodea la
banda I. En el sitio donde se juntan las dos redes, a la altura de la unión
entre las bandas A e I, el retículo sarcoplásmico forma conductos
anulares de configuración apenas más grandes y más regulares que
envuelven al sarcómero. Estos agrandamientos se denominan
cisternas terminales y sirven como reservorios para el 𝐶𝑎
+2
. La
membrana plasmática de las cisternas terminales contiene
abundantes conductos con compuerta para la liberación 𝑪𝒂
+𝟐
denominados receptores de rianodina (RyR1 es la isoforma primaria
en el músculo esquelético), que participan en la liberación de 𝐶𝑎
+2
en
el sarcoplasma. Alrededor de las miofibrillas y en asociación con el
retículo sarcoplásmico, se localiza una gran cantidad de mitocondrias
y gránulos de glucógeno, que proveen la energía necesaria para las
reacciones que intervienen en la contracción. La superficie luminal del
retículo sarcoplásmico contiene
calsecuestrina, una proteína fijadora
de calcio muy acídica, capaz de fijar hasta 50 iones de 𝐶𝑎
+2
internalizados. La calsecuestrina permite que los iones Ca21
necesarios para el inicio de la contracción muscular se almacenen en
una concentración alta (hasta 20 mM), mientras que la concentración
de 𝐶𝑎
+2
libre dentro de la luz del retículo sarcoplásmico permanece
muy baja (menos de 1 mM).
El
sistema de túbulos transversos, o sistema T, está compuesto por
numerosas invaginaciones de la membrana plasmática; cada una
recibe el nombre de
túbulo T. Los túbulos T penetran en todos los
niveles de la fibra muscular y se localizan entre las cisternas terminales contiguas a la altura de las uniones
A –I. Contienen
proteínas sensoras de voltaje denominadas receptores sensibles a la dihidropiridina
(DHSR),
conductos transmembrana sensibles a la despolarización, que se activan cuando la membrana
plasmática se despolariza.
Los cambios en la conformación de estas proteínas afectan directamente los
conductos con compuerta para la liberación de 𝐶𝑎
+2
(isoforma RyR1de receptores de rianodina) ubicados
en la membrana plasmática contigua a las cisternas terminales.
El complejo formado por el túbulo T y las dos cisternas terminales
contiguas se denomina
tríada. Estas estructuras se encuentran en el
músculo esquelético a la altura de las uniones A- I. Las tríadas son
elementos importantes para los fenómenos de adhesión extracelular
(p. ej., estimulación nerviosa) con respuestas intracelulares (p. ej.,
liberación de 𝐶𝑎
+2
) que conducen a la contracción muscular.
La despolarización de la membrana del túbulo T desencadena la
liberación de Ca21desde las cisternas terminales para iniciar la
contracción muscular por cambios en los filamentos delgados.
Cuando un impulso nervioso llega a la unión neuromuscular, la
liberación del neurotransmisor (acetilcolina) desde el extremo
nervioso desencadena una despolarización localizada de la
membrana plasmática de la célula muscular. La despolarización, a su
vez, provoca la abertura de los
conductos de 𝑵𝒂
+
activados por
voltaje
en la membrana plasmática, lo que permite la entrada de Na+
desde el espacio extracelular hacia el interior de la célula muscular.
La entrada de 𝑁𝑎
+
produce una despolarización generalizada que se
esparce con rapidez sobre toda la membrana plasmática de la fibra
muscular. Cuando la despolarización encuentra con la abertura del
túbulo T, se transmite a lo largo de las membranas del
sistema T hasta las profundidades de la célula. Los cambios eléctricos
activan
las proteínas sensoras de voltaje (DHSR) ubicadas en la
membrana del túbulo T. Estas proteínas tienen las propiedades

María Paula Lorenzo
estructurales y funcionales de los conductos de 𝐶𝑎
+2
. Durante la despolarización del músculo esquelético,
la activación breve de estos sensores no basta para abrir los conductos de Ca21. Por lo tanto, no se
produce el transporte de 𝐶𝑎
+2
desde la luz del túbulo T hacia el sarcoplasma y no es indispensable para
desencadenar el ciclo de contracción. En cambio, la activación de estos sensores abre los conductos con
compuerta para la liberación 𝑪𝒂
+𝟐
(receptores de rianodina) en los sacos terminales contiguos del
retículo sarcoplásmico, que causa la rápida liberación de 𝐶𝑎
+2
en el sarcoplasma. El incremento de la
concentración de 𝐶𝑎
+2
en el sarcoplasma inicia la contracción de la miofibrilla al unirse a la porción TnC
del complejo de troponina en los filamentos delgados. El cambio en la conformación molecular de la TnC
hace que la TnI se disocie de las moléculas de actina; esto permite que el complejo de troponina deje al
descubierto los sitios de unión a miosina en las moléculas de actina. Las cabezas de miosina ahora tienen
libertada para interactuar con las moléculas de actina para iniciar el ciclo de contracción muscular.
La relajación muscular es el resultado de la reducción de la concentración de Ca21 citosólico libre.
Al mismo tiempo, una
bomba de ATPasa activada por 𝑪𝒂
+𝟐
en la membrana del retículo sarcoplásmico
transporta Ca21
de retorno al sitio de almacenamiento sarcoplásmico. La baja concentración de 𝐶𝑎
+2
libre
dentro del retículo sarcoplásmico
es mantenida por la calsecuestrina, una proteína fijadora de calcio que
colabora en la eficiencia de la captación de 𝐶𝑎
+2
.
La unión del 𝐶𝑎
+2
a la calsecuestrina dentro del retículo
sarcoplásmico
reduce, por lo tanto, el gradiente de concentración de 𝐶𝑎
+2
libre contra el cual debe
funcionar la bomba de
ATPasa activada por 𝐶𝑎
+2
. La concentración de 𝐶𝑎
+2
de reposo se restablece en
el citosol en menos de 30 milisegundos.
Esta restauración de la concentración de 𝐶𝑎
+2
de reposo cerca
de los miofilamentos normalmente relaja el músculo y provoca que la contracción se detenga. La
contracción, no obstante,
continuará en tanto los impulsos nerviosos continúen despolarizando la
membrana plasmática de los túbulos T.
Inervación motora
Las fibras del músculo esquelético están muy inervadas por las neuronas motoras que se originan en la
médula espinal o en el tronco del encéfalo. Los axones de las neuronas se ramifican a medida que se
acercan al músculo, dando origen a ramitas o ramificaciones terminales que finalizan sobre fibras
musculares individuales.

María Paula Lorenzo
La unión neuromuscular es el contacto que realizan las ramificaciones terminales del axón con la fibra
muscular.
A la altura de la
unión neuromuscular (placa motora terminal) finaliza la vaina de mielina del axón, y el
segmento terminal de éste permanece cubierto sólo por una delgada porción de la
célula del neurilema
(célula de Schwann)
con su lámina externa. El extremo del axón se ramifica en varias terminaciones, cada
una de las cuales yace en una depresión poca profunda en la superficie de la fibra muscular, la región
receptora. La terminación del axón es una estructura presináptica normal y posee muchas mitocondrias
y vesículas sinápticas que contienen el neurotransmisor
acetilcolina (ACh).
La liberación de acetilcolina en la hendidura sináptica inicia la despolarización de la membrana
plasmática, lo cual conduce a la contracción de la célula muscular.
La membrana plasmática de la fibra muscular que subyace en las hendiduras sinápticas tiene muchos
repliegues de unión (repliegues subneurales) profundos. Los receptores colinérgicos específicos para la
ACh están limitados a la membrana plasmática que bordea inmediatamente la hendidura y a la porción
apical de los repliegues. La lámina externa se extiende hacia el interior de los repliegues de unión. Las
vesículas sinápticas de la terminal axónica liberan ACh hacia la hendidura, que entonces se une a los
receptores de ACh nicotínicos (nAChR) en el sarcolema del músculo estriado. El receptor de ACh
nicotínico en los músculos estriados es un
canal de 𝑵𝒂
+
activado por neurotransmisor. La unión de la
ACh abre los conductos de Na1, con lo que se produce la entrada de Na1 en la célula muscular estriada.
Esta entrada causa una despolarización localizada de la membrana, que a su vez conduce a los fenómenos
ya descritos (v. fig. 11-14a). Una enzima denominada
acetilcolinesterasa (AChE) degrada la acetilcolina
con rapidez para impedir la estimulación continua. Para una descripción más detallada de la función de
ACh.
La transmisión neuromuscular puede bloquearse por toxinas bacterianas
y agentes farmacológicos. Por ejemplo, la toxina botulínica, producida
por una bacteria anaeróbica llamada clostridium botulinum, bloquea la
liberación de ACh desde la terminal axónica. La toxina botulínica escinde
las proteínas del receptor de proteína soluble de unión al factor sensible
a N-etilmaleimida (SNARE) que son esenciales para la unión y la fusión de
las vesículas sinápticas con la membrana presináptica (ver pág. 39). La
transmisión en la unión neuromuscular también puede ser inhibida por el
bloqueo postsináptico mediante varios venenos y agentes
farmacológicos. Los derivados del curare, un veneno paralizante utilizado
en las puntas de las flechas en Sudamérica, se une a los receptores de ACh
nicotínicos sin abrir los conductos iónicos. El veneno causa parálisis de los
músculos esqueléticos (incluido el diafragma) sin afectar directamente la
contracción del músculo cardíaco. Otros compuestos farmacológicos
como la succinilcolina se unen a la nAChR, lo que causa la apertura de los
conductos iónicos. La succinilcolina es usada como un relajante muscular
de corto plazo en la medicina de emergencia y durante los procedimientos
quirúrgicos.
El citoplasma de la fibra muscular que está por debajo de los repliegues
de unión contiene núcleos, muchas mitocondrias, retículo endoplásmico
rugoso (RER), ribosomas libres y glucógeno. Se cree que estos orgánulos
citoplasmáticos intervienen en la síntesis de los receptores específicos de
acetilcolina
de la membrana de la hendidura, así como en la de acetilcolinesterasa.
Una neurona junto con las fibras musculares específicas que la inervan se denomina unidad motora.
Una neurona individual puede inervar desde unas cuantas fibras musculares hasta un centenar o más. Los
músculos capaces de realizar los movimientos más delicados poseen la cantidad más pequeña de fibras
musculares por neurona motora en sus unidades motoras. Por ejemplo, en los músculos oculares, la
relación de inervación es de alrededor de una neurona cada tres fibras musculares. En los músculos
posturales del dorso, una sola neurona puede inervar cientos de fibras musculares.

María Paula Lorenzo
La naturaleza de la contracción muscular está determinada por la cantidad de terminaciones de neuronas
motoras y por la cantidad de tipos de fibras musculares específicos que las despolarizan. Si bien la
despolarización de una fibra muscular en una sola unión neuromuscular se caracteriza como un fenómeno
de “todo o nada”, no todas las terminales nerviosas se disparan al mismo tiempo, lo que permite una
respuesta graduada al estímulo contráctil.
La inervación es necesaria para que las células musculares mantengan su integridad estructural.
La célula nerviosa motora no sólo instruye a las células musculares para que se contraigan sino que
también ejerce una influencia trófica sobre las mismas.
Si se interrumpe la inervación de un músculo, las
células musculares sufren cambios
regresivos conocidos como atrofia tisular. El signo más obvio de esta
atrofia es el adelgazamiento del músculo y de sus células.
Si la inervación se restablece por medio de
cirugía o por
el proceso más lento de regeneración natural del nervio, el músculo puede recuperar su
forma y su fuerza normales.
Los fenómenos que conducen a la contracción del músculo esquelético pueden ser resumidos en una
serie de pasos.
Los fenómenos que ocurren en la contracción se pueden resumir como sigue:
1. La contracción de una fibra muscular esquelética se inicia cuando un impulso nervioso que
avanza a lo largo del axón de una neurona motora llega a la unión neuromuscular.
2. El impulso nervioso desencadena la liberación de acetilcolina en la hendidura sináptica que se
une a conductos de 𝑁𝑎
+
activados por ACh, lo que causa la despolarización local del sarcolema.
3. Se abren los conductos de 𝑁𝑎
+
activados por voltaje y el 𝑁𝑎
+
entra a la célula.
4. La despolarización se generaliza por la membrana plasmática de la célula muscular y continúa a
través de las membranas de los túbulos T.
5. Las proteínas sensoras del voltaje (DHSR) en la membrana plasmática de los túbulos T cambian
su conformación.
Este documento contiene más páginas...
Descargar Completo
Sistema Linfático ROSS.pdf
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Descargar
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.