3
S E R I E
Estructura atómica, estructura electrónica
y Tabla Periódica
1. Estructura atómica
1.1 Guía de Estudio
SUGERENCIA:
Antes de resolver ejercicios de
la sección 1.2, responder pri-
mero los ítems de la Guía de
Estudio relacionados con cada
uno.
Indicar cuáles son las partículas subatómicas fundamentales, su carga y su masa.
¿Cómo están distribuidas en un átomo?
¿Cuál es la relación aproximada entre el tamaño del núcleo y el tamaño del átomo?
¿Cómo es la densidad del núcleo comparada con la densidad del átomo?
Definir número atómico, número másico y nucleido.
¿Cuándo dos o más nucleidos son isótopos entre sí? ¿Cuándo son isóbaros?
Indicar qué es un ion. ¿Cómo se denomina de acuerdo con su carga?
¿Cuál es la unidad que suele utilizarse para expresar la masa atómica (
m
a
)? Indicar
su equivalencia en gramos y en kilogramos.
Indicar cómo se calcula la masa promedio de los átomos de un elemento.
1.2 Ejercicios
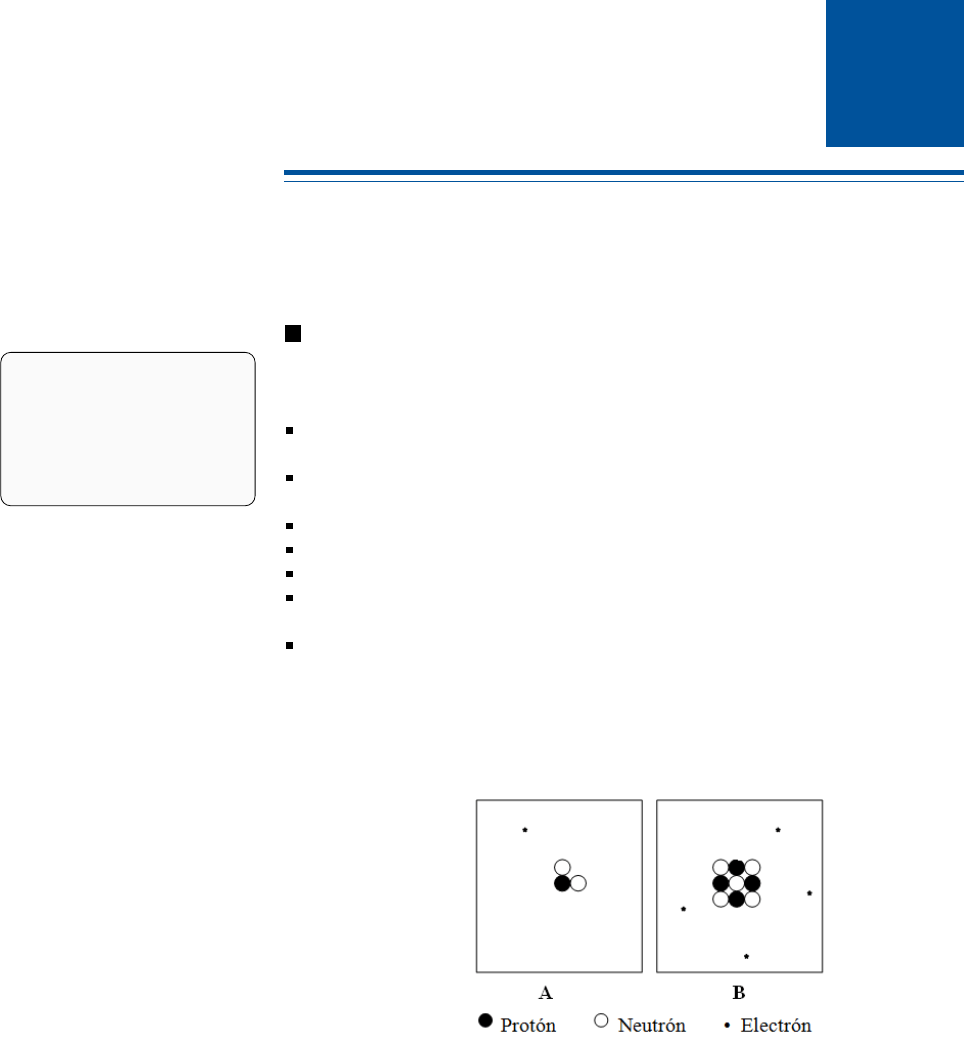
3.1
Determinar el número atómico (
Z
), el número másico (
A
) y el símbolo de cada
uno de los átomos representados por:
3.2
Indicar el número de cada una de las partículas subatómicas presentes en los
nucleidos siguientes.
a)
41
20
Ca; b)
85
35
Br; c)
238
92
U.
3.3 Dados los nucleidos:
42
20
Z,
59
28
Q,
40
20
M,
41
19
L,
59
27
R,
38
18
A,
39
19
E,
60
27
G,
40
18
X y
37
17
T,
a) identificarlos con sus símbolos químicos;
b) indicar cuáles son isótopos entre sí;
c) indicar cuáles son isóbaros entre sí.
3.4
Indicar con la notación adecuada (
A
Z
X
, donde X es el símbolo químico,
A
el
número másico y Z el número atómico), a los nucleidos que contienen:
a) 6 protones y 7 neutrones;
b) 10 protones y 13 neutrones;
c) 17 protones y 20 neutrones.
9

10 Estructura atómica, estructura electrónica y Tabla Periódica
3.5
Escribir ecuaciones que representen la obtención de los cationes siguientes a
partir de los átomos correspondientes: a)
57
26
Fe
3+
; b)
140
56
Ba
2+
; c)
27
13
Al
3+
.
3.6
Escribir ecuaciones que representen la obtención de los aniones siguientes a
partir de los átomos correspondientes: a)
125
53
I
–
; b)
32
16
S
2 –
; c)
31
15
P
3 –
.
3.7
Para cada uno de los iones siguientes detallar el número de protones, neutrones
y electrones: a)
52
24
Cr
3+
; b)
80
34
Se
2 –
; c)
131
53
I
–
; d)
137
55
Cs
+
.
3.8
¿Cuál de los símbolos siguientes representa a una especie X que contiene 10
electrones, 7 protones y 8 neutrones?
a)
15
7
X; b)
15
8
X
3+
; c)
15
7
X
3 –
; d)
15
8
X
3 –
.
3.9 Indicar con la notación adecuada:
a) la especie que contiene 8 protones, 8 neutrones y 10 electrones;
b) el catión monovalente que contiene 11 protones y 12 neutrones;
c) el anión divalente que contiene 16 protones y 18 neutrones.
3.10
Escribir el símbolo químico del átomo que es isoelectrónico con cada uno de los
iones siguientes: a)
37
Rb
+
; b)
4
Be
2+
; c)
8
O
2 –
.
3.11 Dados los nucleidos
49
24
X,
18
9
E,
60
27
R,
50
23
T,
59
26
Q y
40
19
J:
a) determinar en cada caso a cuál elemento corresponden;
b) indicar el número de neutrones que posee cada uno;
c) indicar el número de cada una de las partículas subatómicas que constituyen
las especies X
3+
, R
2+
, Q
3+
y E
–
;
d) indicar el símbolo químico del catión monovalente isoelectrónico con E
–
;
e) indicar el símbolo químico del anión monovalente isoelectrónico con J
+
.
3.12
Completar el cuadro siguiente, utilizando la Tabla Periódica en los casos en que
no se indique el símbolo del elemento químico.
Símbolo Carga Z A
Número de:
protones neutrones electrones
115
48
Cd
0 48 115 48 67 48
?
17
Cl
–
20
0 127 53
2+ 124 80
84
37
Rb
+
2– 34 40
?
29
Cu
2+
65
?
10
Ne
10
1– 35 81

Química CBC Cátedra Bruno-Di Risio 2021 11
3.13 Indicar si las afirmaciones siguientes son correctas (C) o incorrectas (I).
a)
“Cuando un átomo de sodio (
Z
=11,
A
=23) pierde un electrón se transforma
en el ion
22
11
Na
+
.”
b) “Los nucleidos
39
19
X y
39
18
Z son isótopos porque tienen igual número másico.”
c) “Cuando el nucleido
16
8
O gana 2 electrones se transforma en
16
8
O
2 –
.”
d) “Los nucleidos
107
47
M y
109
47
M son isótopos porque tienen el mismo número de
protones y distinto número de neutrones.”
3.14 La masa del nucleido
23
Na es 22,989768 u. Calcular:
a) la masa de un átomo expresada en gramos y en kilogramos;
b) la masa de mil átomos expresada en gramos.
3.15
Los isótopos estables del elemento boro son
10
5
B
y
11
5
B
. El primero tiene
m
a
= 10,01 u y su abundancia en la naturaleza es 19,90%. El segundo tie-
ne m
a
= 11,01 u y su abundancia en la naturaleza es 80,10%.
m
a
=
P
i
(m
i
· %AI
i
)
100
Para el
i
-ésimo isótopo,
m
i
es su
masa y
%AI
i
su abundancia iso-
tópica terrestre promedio en por-
centaje de cantidad [(
n
i
/
n
total
)
×
100].
a)
Calcular la masa atómica promedio del elemento boro expresada en unidades
de masa atómica.
b) Calcular la masa atómica promedio expresada en gramos.
3.16
La masa atómica promedio de los átomos del elemento cloro es 35,45 u. Se sabe
que sus isótopos estables son
35
Cl
y
37
Cl
. ¿Cuál de los dos isótopos debe tener
una abundancia mayor de acuerdo con estos datos?
2. Estructura electrónica de los átomos
2.1 Guía de Estudio
SUGERENCIA:
Antes de resolver ejercicios de
la sección 2.2, responder pri-
mero los ítems de la Guía de
Estudio relacionados con cada
uno.
Todas las configuraciones electró-
nicas de esta guía corresponden
a las de los correspondientes es-
tados fundamentales o basales de
las especies involucradas.
Describir el modelo de Bohr y el modelo orbital. ¿Qué son los números cuánticos?
¿A qué se llama nivel electrónico en el marco del modelo orbital?
¿Qué son los orbitales atómicos? ¿Cómo se simbolizan? ¿Cuál es el número máximo
de electrones en cada uno de ellos?
¿Cuál es el orden creciente de energía orbital en un átomo polielectrónico?
Indicar qué se entiende por configuración electrónica (CE) y por configuración
electrónica externa (CEE) de un átomo.
Describir el orden de “ocupación” de los diferentes orbitales para predecir la con-
figuración electrónica del estado fundamental de un átomo polielectrónico (regla
de las diagonales). Dicha ocupación, ¿se efectúa siempre en sentido creciente de la
energía orbital?
2.2 Ejercicios
(1s)
2
(2s)
2
(2p)
6
|
{z }
CE del neón
(3s)
1
≡ [Ne](3s)
1
3.17
Escribir la configuración electrónica (CE) de los átomos siguientes, en forma
detallada y en notación abreviada de gas noble: a) potasio; b) bario; c) vanadio;
d) fósforo.
3.18
Escribir la configuración electrónica externa (CEE) de los átomos siguientes:
a) cloro; b) xenón; c) estroncio; d) selenio.
3.19
Escribir la CE del neón y la del ion
Mg
2+
. ¿Se trata de especies isoelectrónicas?
¿Por qué sí o por qué no?
3.20 Escribir la CE del catión divalente del calcio.
3.21 Escribir la CE del anión monovalente del bromo.
3.22 Escribir la CEE del ion Al
3+
. ¿Qué ion del oxígeno tiene la misma CEE?

12 Estructura atómica, estructura electrónica y Tabla Periódica
3.23
La CEE de los átomos del elemento Z es (4s)
2
(4p)
5
. Indicar cuántos protones
tiene Z, identificarlo con su símbolo químico y escribir su CE en forma detallada
y en notación abreviada de gas noble.
3.24
Identificar con sus símbolos químicos a los elementos cuyos átomos tienen las
configuraciones electrónicas siguientes:
a) (1s)
2
(2s)
2
(2p)
6
(3s)
2
(3p)
4
;
b) [Ar](3d)
10
(4s)
2
;
c) (1s)
2
(2s)
2
(2p)
6
(3s)
2
(3p)
6
(4s)
1
;
d) [Xe](6s)
1
.
3.25 El anión trivalente de X tiene la CE [Ne](3s)
2
(3p)
6
.
a) Identificar al elemento X con su símbolo químico.
b) Si un átomo de X tiene 16 neutrones, ¿cuál es su número másico?
3.26 Indicar con su símbolo químico y carga eléctrica un anión y un catión que sean
isoelectrónicos con el elemento cuyo Z = 36.
3.27
Los iones
88
Q
2+
y
34
Se
2 –
son isoelectrónicos entre sí. Identificar al elemento Q
con su símbolo químico. ¿Cuántos neutrones posee el nucleido
88
Q?
3.28
A
Z
M
2+
es un catión isoelectrónico con el argón y su núcleo contiene 22 neutrones.
Indicar su notación completa.
3. Tabla Periódica de los elementos
3.1 Guía de Estudio
SUGERENCIA:
Antes de resolver ejercicios de
la sección 3.2, responder pri-
mero los ítems de la Guía de
Estudio relacionados con cada
uno.
Identificar toda la información que se puede obtener en un casillero (correspondiente
a un elemento) de la Tabla Periódica. ¿Qué masa atómica se informa? ¿Cómo suelen
presentarse las configuraciones electrónicas? ¿Las configuraciones electrónicas
coinciden siempre con las obtenidas por la “regla de las diagonales”? ¿Por qué?
Indicar cuál es la relación entre la configuración electrónica y la ubicación de un
elemento en la Tabla Periódica.
¿Qué es un grupo y qué es un período en la Tabla Periódica? ¿Cuántos grupos y
cuántos períodos hay en la Tabla Periódica?
¿Cuáles son los grupos denominados principales?
Identificar a los elementos pertenecientes a los grupos de los metales alcalinos, de los
metales alcalino térreos, del grupo del nitrógeno (pnictógenos), de los calcógenos,
de los halógenos y de los gases nobles.
¿Qué se entiende por carácter metálico?
Definir carga nuclear efectiva y describir cualitativamente cómo varía a lo largo de
un período y a lo largo de un grupo.
Definir energía de primera ionización.
¿Qué se entiende por radio atómico? Averiguar métodos para su determinación.
¿Por qué la energía de primera ionización y el radio atómico son, entre muchas otras,
propiedades periódicas de los átomos de los elementos? Describir sus variaciones
generales a lo largo de un período y a lo largo de un grupo.
3.2 Ejercicios
3.29
En base a lo solicitado en la guía de estudio de esta sección, indicar la informa-
ción que puede obtenerse de la Tabla Periódica que acompaña este material para
los elementos: F, Cr, As y Ba.
3.30
Identificar con su simbolo químico, escribir su CEE e indicar a cuáles grupo
y período pertenecen los elementos siguientes: a) el segundo halógeno; b) el
primer metal alcalino; c) el cuarto gas noble; d) el tercer metal alcalinotérreo.

Química CBC Cátedra Bruno-Di Risio 2021 13
3.31
Indicar si los elementos cuyo
Z
es: a) 20; b) 34; c) 46; d) 53; e) 78; f) 86;
g) 94, son metales alcalinos, metales alcalinotérreos, no metales, gases nobles,
metales de transición o elementos de transición interna.
3.32
Escribir el símbolo químico e indicar a cuál período y grupo pertenecen los
elementos siguientes: 1) aquel cuyo
Z
= 22; 2) aquel cuyo
Z
es una unidad menor
que el del segundo halógeno; 3) el que forma un catión divalente isoelectrónico
con el átomo de kriptón.
3.33
Escribir la CE de dos cationes y de dos aniones que sean isoelectrónicos con el
tercer gas noble, identificándolos con sus símbolos químicos y cargas eléctricas.
3.34
Dados los elementos Na, Rb, Mg, Al, Si, S, Cl y P, seleccionar los siguientes:
1) al no metal que forma aniones monovalentes, 2) aquel cuyo catión más común
es trivalente, 3) aquel cuyos átomos tienen CEE = (3s)
2
(3p)
4
, 4) aquel con mayor
carácter metálico, 5) aquel cuyo anión más común es trivalente, 6) el metal cuyo
ion divalente es isoelectrónico con el neón.
3.35
Identificar a los elementos R y Q indicando su grupo y período, sabiendo que el
catión divalente de R tiene 54 electrones y la CEE del anión monovalente de Q
es (2s)
2
(2p)
6
.
3.36
La CEE del catión monovalente de X es (4s)
2
(4p)
6
. Escribir el símbolo químico
del elemento X, su grupo y su período e indicar el número másico del nucleido
de X que tiene 49 neutrones en su núcleo.
3.37 El elemento Q forma un anión divalente isoelectrónico con el tercer gas noble.
a)
Identificar a Q con su símbolo químico, indicando el grupo y el período al
que pertenece.
b) Calcular el número de neutrones del isótopo de Q que tiene A = 34.
3.38
El ion
J
2+
es isoelectrónico con el tercer gas noble. El elemento M es el quinto
metal alcalino. El anión divalente de R es isoelectrónico con el argón.
a) Identificar a los elementos J, M y R con sus símbolos químicos.
b) Entre los elementos J, M y R seleccionar al de mayor carácter metálico.
c) Escribir la CEE de los átomos de R.
4. Respuestas seleccionadas
Estructura atómica
3.1
: A:
3
1
H; B:
9
4
Be.
3.2: a) 20 p, 21 n y 20 e; b) 35 p, 50 n y 35 e; c) 92 p, 146 n y 92 e.
3.3:
a)
42
20
Ca
,
59
28
Ni
,
40
20
Ca
,
41
19
K
,
59
27
Co
,
38
18
Ar
,
39
19
K
,
60
27
Co
,
40
18
Ar
y
37
17
Cl
; b)
42
20
Ca
y
40
20
Ca,
41
19
K y
39
19
K,
38
18
Ar y
40
18
Ar,
59
27
Co y
60
27
Co; c)
40
20
Ca y
40
18
Ar,
59
28
Ni y
59
27
Co.
3.4: a)
13
6
C; b)
23
10
Ne; c)
37
17
Cl.
3.5:
a)
57
26
Fe
57
26
Fe
3+
+
3e
–
; b)
140
56
Ba
140
56
Ba
2+
+
2e
–
; c)
27
13
Al
27
13
Al
3+
+
3e
–
.
3.6: a)
125
53
I + e
–
125
53
I
–
; b)
32
16
S + 2e
– 32
16
S
2 –
; c)
31
15
P + 3e
– 31
15
P
3 –
.
3.7:
a) 24 p, 28 n y 21 e; b) 34 p, 46 n y 36 e; c) 53 p, 78 n y 54 e; d) 55 p, 82 n y 54
e.
3.8:
15
7
X
3 –
.
3.9: a)
16
8
O
2 –
; b)
23
11
Na
+
; c)
34
16
S
2 –
.
3.10: a) Kr; b) He; c) Ne.
3.11:
a) Cr, F, Co, V, Fe y K, respectivamente; b) 25, 9, 33, 27, 33 y 21, respectiva-
mente; c) 24 p, 25 n y 21 e; 27 p, 33 n y 25 e; 26 p, 33 n y 23 e; 9 p, 9 n y 10 e,
respectivamente; d) Na
+
; e) Cl
–
.

14 Estructura atómica, estructura electrónica y Tabla Periódica
3.12:
Símbolo Carga Z A
Número de:
protones neutrones electrones
115
48
Cd
0 48 115 48 67 48
37
17
Cl
–
1– 17 37 17 20 18
127
53
I
0 53 127 53 74 53
206
82
Pb
2+
2+ 82 206 82 124 80
84
37
Rb
+
1+ 37 84 37 47 36
74
34
Se
2 –
2– 34 74 34 40 36
65
29
Cu
2+
2+ 29 65 29 36 27
20
10
Ne
0 10 20 10 10 10
81
35
Br
–
1– 35 81 35 46 36
3.13: a) I; b) I; c) C; d) C.
3.14: a) 3,818 × 10
−23
g, 3,818 × 10
−26
kg; b) 3,818 × 10
−20
g.
3.15: 10,81 u, 1,795 × 10
−23
g.
3.16: El isótopo
35
Cl.
Estructura electrónica de los átomos
3.17
: a) (1s)
2
(2s)
2
(2p)
6
(3s)
2
(3p)
6
(4s)
1
, [Ar](4s)
1
;
b) (1s)
2
(2s)
2
(2p)
6
(3s)
2
(3p)
6
(3d)
10
(4s)
2
(4p)
6
(4d)
10
(5s)
2
(5p)
6
(6s)
2
, [Xe](6s)
2
;
c) (1s)
2
(2s)
2
(2p)
6
(3s)
2
(3p)
6
(3d)
3
(4s)
2
, [Ar](3d)
3
(4s)
2
;
d) (1s)
2
(2s)
2
(2p)
6
(3s)
2
(3p)
3
, [Ne](3s)
2
(3p)
3
.
3.18: a) (3s)
2
(3p)
5
; b) (5s)
2
(5p)
6
; c) (5s)
2
; d) (4s)
2
(4p)
4
.
3.19:
(1s)
2
(2s)
2
(2p)
6
; son especies isoelectrónicas porque tienen el mismo número de
electrones.
3.20: (1s)
2
(2s)
2
(2p)
6
(3s)
2
(3p)
6
.
3.21: (1s)
2
(2s)
2
(2p)
6
(3s)
2
(3p)
6
(3d)
10
(4s)
2
(4p)
6
.
3.22: (2s)
2
(2p)
6
. El ion O
2 –
.
3.23: 35 p; Br; (1s)
2
(2s)
2
(2p)
6
(3s)
2
(3p)
6
(3d)
10
(4s)
2
(4p)
5
; [Ar](3d)
10
(4s)
2
(4p)
5
.
3.24: a) S; b) Zn; c) K; d) Cs.
3.25: a) P; b) A = 31.
3.26: Br
–
y Rb
+
.
3.27: Sr, 50 neutrones.
3.28:
42
20
Ca
2+
.
Tabla Periódica de los elementos
3.29
:
Símbolo Nombre Z m
a
/ u E.Ox. EN CE
F flúor 9 19,00 –1 3,98 (1s)
2
(2s)
2
(2p)
5
Cr cromo 24 52,00 2, 3, 6 1,66 [Ar](3d)
5
(4s)
1
As arsénico 33 74,92 ±3, 5 2,18 [Ar](3d)
10
(4s)
2
(4p)
3
Ba bario 56 137,3 2 0,89 [Xe](6s)
2
3.30:
a) Cl, (3s)
2
(3p)
5
, grupo 17, período 3; b) Li, (2s)
1
, grupo 1, período 2; c) Kr,
(4s)
2
(4p)
6
; grupo 18, período 4; d) Ca, (4s)
2
, grupo 2, período 4.
3.31:
a) metal alcalinotérreo; b) no metal; c) metal de transición; d) no metal;
e) metal de transición; f) gas noble; g) elemento de transición interna.
3.32: 1) Ti, P=4, G=4; 2) S, P=3, G=16; 3) Sr, P=5, G=2.
3.33: K
+
y Ca
2+
; Cl
–
y S
2 –
; CE: [Ne](3s)
2
(3p)
6
.
Química CBC Cátedra Bruno-Di Risio 2021 15
3.34: 1) Cl; 2) Al; 3) S; 4) Rb; 5) P; 6) Mg.
3.35: R: Ba, G: 2, P: 6; Q: F, G: 17; P: 2.
3.36: Rb, G: 1, P: 5, A = 86.
3.37: a) S, G: 16, P: 3; b) 18 n.
3.38: a) J: Ca, M: Cs, R: S; b) Cs; c) (3s)
2
(3p)
4
.

Serie 11.pdf
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Descargar
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.