TEMA I: Generalidades de Farmacología.
Conferencia 1. Generalidades de la Farmacología. Etapas para desarrollar un
nuevo medicamento.
Resumen
La
farmacología es una ciencia que abarca el conocimiento de la historia, origen y uso de los
compuestos farmacológicamente activos (Fármacos), así como sus propiedades físicas y
químicas, asociaciones, efectos del fármaco sobre el organismo (Farmacodinamia), y efectos
del organismo sobre el fármaco (absorción, distribución, biotransformación y excreción).
Fuente de obtención de medicamentos
Vegetal
Ej. Digitalis purpurea (Digoxina, Tto. ICC)
Papaver somníferum (Morfina, Tto. Dolor)
Animal
Ej. Insulina (se obtuvo en los primeros tiempos del páncreas del cerdo, en la actualidad se
puede obtener por otras fuentes, ver figura), se emplea en el tratamiento de la Diabetes
mellitus.
Mineral
Ej. Hidróxido de aluminio y de magnesio, Bicarbonato de sodio (Tratamiento de hiperacidez
estomacal)
Sintético o biosintético: Los principios activos obtenidos de las plantas medicinales o de los
hongos son susceptibles de
ser modificados estructuralmente para mejorar su
comportamiento. También se ha podido obtener fármacos a partir del conocimiento de la
estructura de receptores.
El desarrollo de un nuevo medicamento es un proceso largo y costoso cuyo objeto es
demostrar en distintas fases, descubrimiento, preclínica y clínica, que el nuevo fármaco reúne
los requisitos de eficacia, seguridad y calidad exigidos para su comercialización y
administración al ser humano.
INVESTIGACIÓN PRECLÍNICA
Los estudios preclínicos tienen como objetivos obtener información básica acerca de la
seguridad de la sustancia en investigación y su actividad farmacológica, es decir, su
capacidad de producir un efecto terapéutico y los mecanismos por los cuales produce dicha
respuesta; es esta fase preclínica también se estudia la toxicidad de la sustancia, con el fin de
establecer un margen terapéutico que indique cuál es la dosis necesaria para que se
presenten los efectos deseados y cuál es la dosis en la cual se empiezan a presentar efectos
adversos y tóxicos; este margen terapéutico es necesario para los estudios clínicos, donde las
dosis iniciales administradas a los humanos son más bajas que las utilizadas en los animales.
Alternativas de investigación: órgano aislado, sistema biológico (cultivo de bacteria, cultivo de
tejido, insectos, sistema enzimáticos, etc.)
ESTUDIOS FARMACOLÓGICOS PRECLÍNICOS: Los estudios de farmacología preclínica
analizan las propiedades farmacodinamicas y farmacocinéticas de un producto en
investigación
Diseños empleados
Tamizaje: Diseño que permite la identificación de compuestos que presenten actividad sobre
un blanco o función especifica, potenciando que se conviertan en candidatos a una
evaluación que permita el desarrollo hacia aplicaciones clínicas.
TÉCNICA CUALITATIVA
Tipos:
Dirigido: permite hallar una determinada acción farmacológica en uno o varios compuestos.
A ciegas: realiza la pesquisa de múltiples actividades biológicas que pudieran estar presentes
en uno o varios compuestos para orientar hacia la acción a la que se van a dirigir los estudios
posteriormente.
Bioensayo: Procedimiento biológico que permite valorar el efecto y la potencia de una
sustancia.TÉCNICA CUANTITATIVA.Para estudiar la actividad farmacológica se emplean las
curvas dosis-respuesta (curvas D-R, CDR, o curvas dosis respuestas graduales), que
permiten cuantificar o estimar el efecto de una dosis dada y da la medida de la magnitud de
la actividad del compuesto investigado a una dosis determinada. (
CURVA DOSIS – RESPUESTA
Pendiente:
Expresa el mecanismo de acción de una sustancia e incluye la forma de la curva
que caracteriza la unión de la sustancia con su receptor.Rige el límite de dosis que es útil
para alcanzar un efecto clínico.
Potencia:Es la dosis requerida de una sustancia para producir un efecto determinado.
Depende de la afinidad de los receptores por unirse con el fármaco, de la eficacia de la
interacción droga-receptor y de la capacidad para alcanzar el sitio receptor.
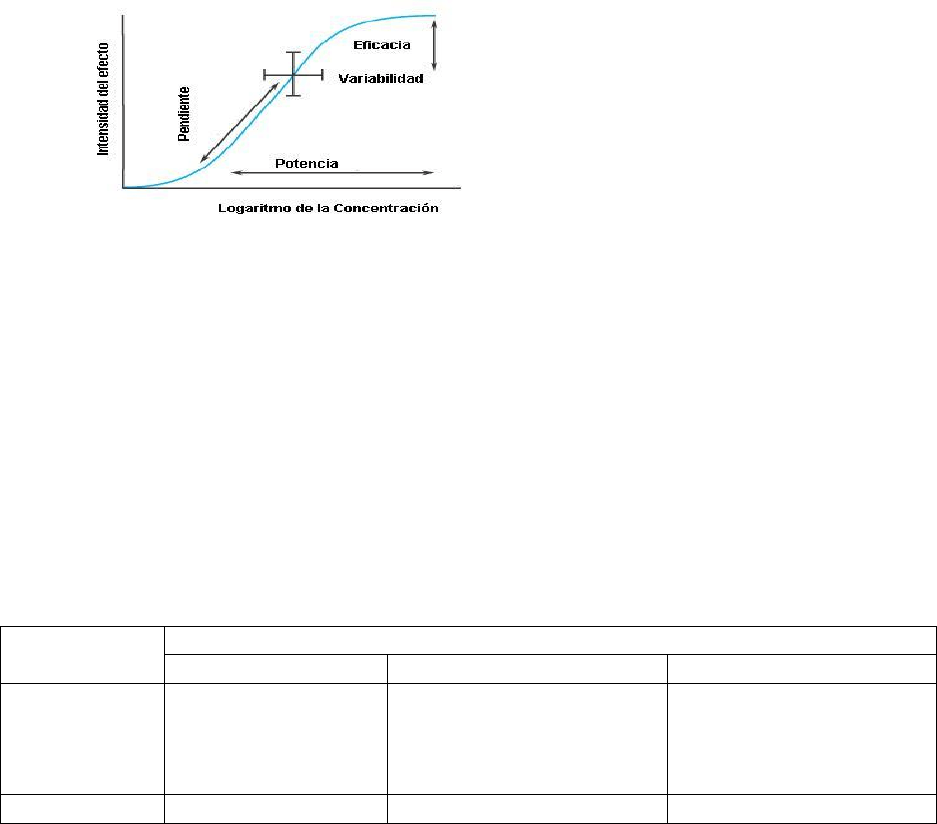
Eficacia:Es la capacidad de un compuesto de producir un efecto máximo. Depende de las
propiedades de la sustancia y de su sistema receptor-efector; se expresa a través de la fase
de estabilización de la CDR.Está limitada por la aparición de efectos indeseables.
Variabilidad biológica:
Las barras perpendiculares indican que se producirá un efecto de intensidad variable en
individuos diferentes, con una concentración específica de una sustancia o que se necesita
una gama determinada de concentraciones para producir un efecto de intensidad específica
en todos los pacientes.Una curva dosis –efecto es válida sólo para un sujeto en un momento
determinado o para un individuo promedio.
Tipos:
Interindividual: Diferencia en la magnitud de la respuesta al aplicar la misma dosis de una
sustancia en individuos diferentes de una misma población.
Intraindividual: Diferencia en la magnitud de la respuesta al aplicar la misma dosis en un
individuo en momentos diferentes.
ESTUDIOS TOXICOLÓGICOS PRECLÍNICOS: En la evaluación toxicológica de nuevas
sustancias se emplean baterías de ensayos en diferentes especies animales, que
comprenden modelos experimentales in vitro e in vivo.
Permiten hacer una evaluación exhaustiva del producto a ensayar a través del
comportamiento de los animales durante un tiempo predeterminado para registrar
cronológicamente las lesiones generadas por la composición, también determinan relación
dosis respuestas de estos efecto
Principales
características
Tipo de estudio
Agudos
Subagudos
Crónicos
Dosis
Administración de una
dosis única o unas
pocas dosis a
intervalos repetidos.
Administración diaria del
medicamento.
Administración diaria del
medicamento.
Duración
24 a 48 horas *
30 a 90 días
6 meses a 2 años

Objetivo
Determinar mortalidad
a corto plazo
Determinar efectos tóxicos
acumulativos
Determinar efectos tóxicos
acumulativos
Mediciones
DL
50
Pruebas de laboratorio
(glicemia, orina, sangre,
transaminasa
y otros)
Alteraciones cardíacas por
electrocardiograma
Temperatura, presión
arterial, nutrición, otros
Alteraciones macro y
microscópicas de los tejidos
y órganos
Estudios especiales
Pruebas de laboratorio
(glicemia, orina, sangre,
transaminasa
y otros)
Alteraciones cardíacas por
electrocardiograma
Temperatura, presión
arterial, nutrición, otros
Alteraciones macro y
microscópicas de los
tejidos y órganos
Requisitos
para su
realización
-3 especies una no
roedora.
-Más de una vía de
administración.
-Uno o más niveles de
dosis
-No menos de dos especie,
una no roedora.
-Vía de administración oral o
por la que el medicamento
se va a administrar.
-Tres niveles de dosis como
mínimo.
-No menos de dos especie,
una no roedora.
-Vía de administración oral
o por la que el
medicamento se va a
administrar.
-Tres niveles de dosis
como mínimo.
Estudios toxicológicos especiales:
1.-Ensayos sobre la reproducción:
Estudios de teratogenicidad, que permiten evaluar la capacidad de producir anomalías
en el desarrollo fetal que se traducen en malformaciones congénitas o muertes.
Estudios de fertilidad, que miden la afectación de este factor por medio del porcentaje de
cópulas que llegan a embarazos, de embarazos que alcanzan su término, de recién
nacidos que arriban a las 4 semanas de vida y otras variables.
Estudios multigeneracionales, que evalúan efectos adversos que se expresan en la
descendencia, por ejemplo el adenocarcinoma de células claras de vagina en las hijas
de madres que tomaron etildietilbestrol durante el embarazo.
2.-Estudios para evaluar el potencial carcinogénico.
Los estudios para evaluar el potencial carcinogénico son necesarios cuando se pretende utilizar
la sustancia en el hombre por períodos prolongados. Deben ser realizados en 2 especies, suelen
durar hasta 2 años y en ellos se estudian alteraciones hematológicas e histológicas, y se
efectúan necropsias.
3.-Estudios sobre la actividad mutagénica o carcinogénica:
Los estudios sobre actividad mutagénica o genotoxicidad valoran el efecto de los fármacos sobre
la estabilidad genética en modelos in vitro como microorganismos (prueba de Ames) o células de
mamíferos en cultivo; pero también in vivo, como en la determinación de micronúcleos en médula
ósea, las malformaciones en espermatozoides o la letalidad dominante en ratones.

Otros estudios especiales pueden desarrollarse durante la etapa preclínica como son las
evaluaciones farmacocinéticas y de interacciones medicamentosas, que permiten una mayor
caracterización del compuesto estudiado.
FASE CLÍNICA
Es necesario que antes de comercializar un fármaco éste sea probado en humanos. Esto se
hace, con la finalidad de asegurar la bondad del nuevo fármaco, en tres fases consecutivas en
diferentes grupos poblacionales, conocidos como estudios farmacológicos clínicos.
La Conferencia Internacional de Armonización (conocida como ICH en inglés) una definición
mucho más amplia que no solo engloba los ensayos clínicos controlados, que expresa: “
un
ensayo clínico/estudio clínico (EC) es cualquier investigación en sujetos humanos,
dirigida a descubrir o verificar los efectos clínicos, farmacológicos y/u otros efectos
farmacodinámicos de un producto en investigación, y/o a identificar cualquier reacción
adversa al producto en investigación, y/o a estudiar la absorción, distribución,
metabolismo y excreción de un producto en investigación, con el objeto de determinar su
seguridad y/o eficacia
”
Existen 4 pilares básicos sobre los cuales se debe realizar un ensayo clínico controlado y que
permiten garantizar la validez de los resultados, estos son:
1. Objetividad de la observación.
2. Comparación concurrente.
3. Asignación aleatoria de los tratamientos.
4. Enmascaramiento.

Objetividad de la observación:Consiste en la utilización de métodos objetivos y reproducibles,
destinados a medir unas variables de respuesta lo más objetiva y “duras” posibles.
La variable dura es aquella que es sensible (permite detectar pequeños cambios en lo
estudiado), consistente o estable (concordancia en las mediciones) es la más reproducible.
Comparación concurrente:El EC controlado es la “Regla de Oro” de la investigación clínica.
Si la finalidad de una intervención es dilucidar cuan eficaz es la misma, el diseño óptimo es
aquel que se comparan en idénticas condiciones 2 grupos (ver figura en clasificación de EC)
Asignación aleatoria de los tratamientos: Significa que los casos son distribuidos al azar en
cada grupo del estudio. El objetivo es conseguir que los diferentes grupos sean comparables u
homogéneos en todas las características excepto en la intervención recibida, evitar las
preferencias subjetivas de los pacientes o de los médicos a la hora de formar los grupos.
Enmascaramiento: El término enmascaramiento se refiere a no informar a los participantes,
investigadores o evaluadores de un ensayo acerca de la intervención asignada. Busca limitar la
incidencia de sesgos en la realización e interpretación de un ensayo clínico (ver clasificación de
los EC por el grado de enmascaramiento)
Tipos de controles:
1.-Controles históricos
2.-Placebo: Placebo deriva del latín y significa literalmente complaceré. Es un preparado
sin sustancias farmacológicamente activas, pero de idéntica apariencia y otras características
organolépticas que el preparado de experimentación, utilizado para tratar a los sujetos controles
con el fin de enmascarar los tratamientos.Idealmente, el placebo debe tener las mismas
características organolépticas con respecto a los 5 sentidos. Ello se refiere tanto al aspecto
visual (tamaño, forma, logotipo, color o viscosidad) como al sabor, olor, peso, textura, e incluso,
en algunos casos, sonido (por ejemplo aerosoles). El gusto es más problemático, aunque existen
técnicas farmacéuticas para disimular los sabores.
3.- Efecto placebo: El efecto placebo ha sido definido como el cambio en el estado del paciente
que está causalmente conectado con el conocimiento (o la conciencia) personal que posee de
encontrarse en una determinada situación clínica
Para la realización de los EC, se debe de cumplir con las Buenas Prácticas Clínicas, BPC son
normas internacionales de calidad científica y ética, establecidas para investigaciones donde
participen sujetos humanos; el cumplimiento de ellas asegura públicamente la protección de los
derechos, la seguridad y el bienestar de los participantes en el ensayo, de acuerdo con los
principios de la Declaración de Helsinki, además, garantiza la credibilidad de los datos obtenidos
en un ensayo clínico.
Tipos de ensayos clínicos
En dependencia del producto de investigación o tecnología sanitaria que se vaya a evaluar,
podrán agruparse en ensayos clínicos con:
1. Medicamentos.
2. Fitofármacos, terapia tradicional o alternativa.
3. Inmunoterapia.
4. Procederes quirúrgicos.

5. Otros procederes (radioterapia, prótesis, etc.).
6. Recomendaciones médicas.
7. Manejos de pacientes.
8. Equipos médicos.
9. Diagnosticadores.
Ahora bien, los ensayos clínicos además de la clasificación anterior, pueden ser clasificados en
dependencia de diferentes factores, como son:
1. Fases del desarrollo clínico del producto.
2. Centros participantes.
3. Grado de enmascaramiento.
4. Tipo de diseño.
5. Tipo de objetivo general que persiga.
6. Propósito o fin por el que se realiza el ensayo.
De acuerdo a las Fases del desarrollo clínico del producto ,se clasifican en:
Fase1: Representa la primera etapa de pruebas en seres humanos.
Su objetivo principal es verificar que el fármaco es tolerado de manera satisfactoria (Seguridad),
aunque a veces también se pueden obtener datos farmacocinéticos y farmacodinámicos
(objetivos específicos).
Fase 2: Los ensayos de fase II buscan principalmente explorar la eficacia terapéutica en los
pacientes a los que se apunta. También buscan calcular la dosis apropiada para los estudios
subsiguientes y proporcionar una base para el diseño, los criterios de valoración y las
metodologías relacionadas de ensayos confirmatorios. Son objetivos además la búsqueda del
mecanismo de acción, la seguridad y la farmacocinética de dosis múltiples.
Fase 3: El objetivo principal de un ensayo de fase III confirmatorio es demostrar o confirmar el
beneficio terapéutico a través del uso de criterios de valoración clínicos importantes, en lugar de
criterios de valoración indirectos.
Otros objetivos pueden ser el de estudiar las poblaciones extendidas de pacientes de un artículo
en estudio, en diferentes etapas de una enfermedad, o como una terapia de combinación con
otro fármaco. Indicaciones, dosis, pautas de tratamiento, seguridad a largo plazo, Interacciones,
farmacocinética clínica y biodisponibilidad. Formulación definitiva.
Registro: Cuando el patrocinador está convencido de que los datos obtenidos en la fase III
justifican aprobar el fármaco como eficaz y seguro para el uso propuesto, solicita una aplicación
de un nuevo fármaco: en Estados Unidos; es la FDA quien aprueba y otorga la aplicación NDA
(por sus siglas en inglés New Drug Application). En Europa es la EMEA, y en Cuba es el
CECMED
Fase 4: Los ensayos de uso terapéutico/fase IV comienzan después de que un fármaco ha sido
aprobado para su distribución o comercialización. En los ensayos de fase IV o de vigilancia
posterior a la comercialización, se realiza la vigilancia de la seguridad –farmacovigilancia– y se
proporciona soporte técnico continuo de ese fármaco. Otros ensayos de fase IV apuntan a
estudiar la efectividad del tratamiento tras la aprobación.

Objetivos: estudios de indicaciones nuevas o modificadas, nuevos régimenes de dosificación,
nuevas formulaciones y nuevas rutas de administración o poblaciones adicionales (Efectividad y
seguridad en grupos especiales y en condiciones reales de la práctica clínica)
De acuerdo a los centros participantes se clasifican en:
Monocéntricos. Son ensayos que se realizan en un solo centro asistencial o de investigación.
Multicéntricos. Son estudios en los que se requiere un número elevado de pacientes y participan
varios hospitales u otros centros de salud, con el objetivo de acelerar el ritmo de inclusión de
pacientes al ensayo.
De acuerdo al Grado de enmascaramiento se clasifican en:
Abiertos. Todos los participantes del ensayo (pacientes, investigadores y otros evaluadores)
conocen el tratamiento que se administra a cada paciente.
Simple ciegas. La técnica se refiere a que una de las partes involucradas, habitualmente los
pacientes que participan en el estudio, desconocen el tratamiento que corresponde a cada
paciente.
Doble ciegas. Es aquella técnica de investigación en la que tanto los pacientes como los
investigadores de un estudio desconocen el tratamiento que corresponde a cada individuo.
Triple ciegas. Es el ensayo donde el paciente, el investigador y el analista de los datos no
conocen el tratamiento que fue asignado a cada paciente, y se utiliza cuando las variables
clínicas que se deben evaluar pueden ser interpretadas de maneras diferentes.
Evaluación a ciegas por terceros. En cualquier tipo de ensayo, especialmente cuando las
circunstancias no permiten enmascarar los tratamientos, otro médico que no esté involucrado en
el seguimiento y el control de los pacientes, y que ignore la medicación administrada, realiza la
evaluación de la respuesta.

Resumen tema 1.pdf
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Descargar
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.