
CARBOHIDRATOS,
LIPIDOS Y PROTEINAS
Noviembre 2023
REPORTE DE LABORATORIO.
Basso, Sophia .
Figuera, Eduardo
Molinares, Jhoseline
Noguera, Ivanna
Rivas, Marlyn
INTEGRANTES:
Laboratorio de Biología
II

CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
2
CARBOHIDRATOS, LIPIDOS Y
PROTEINAS
REPORTE DE LABORATORIO.
Facilitadora:
Lorena Ruiz.
Integrantes:
Basso, Sophia C.I: 26.230.93
Figuera, Eduardo C.I: 27.003.450
Molinares, Jhoseline C.I: 28.059.846
Noguera, Ivanna C.I: 25.811.542
Rivas, Marlyn C.I: 25.685.010
Universidad de Oriente Núcleo Anzoátegui.
Escuela de medicina.
Contenido
Carbohidratos .............................................................................................................................. 32
Lipidos .......................................................................................9
Error! Bookmark not defined.
Proteinas ...............................................................................1Error! Bookmark not defined.

CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
3
CARBOHIDRATOS, LIPIDOS
Y PROTEINAS
Para poder entender que es un carbohidrato hay que analizar de donde
proviene, es decir cuál es la rama principal. Los glúcidos son una subclasificación de las
biomoléculas, estas biomoléculas se dividen en varias clasificaciones, por una parte se
encuentran las biomoléculas inorgánicas y orgánicas anteriormente dichas que se
subdividen en otros tipos de compuestos, los carbohidratos pertenecen a las
biomoléculas orgánicas cuyos elementos representativos son el carbono el oxigeno y el
hidrogeno.
Como primera definición podemos decir que los glúcidos son compuestos o
moléculas orgánicas producto de la fusión de los tres elementos anteriormente
mencionados, a diferencia de los demás compuestos estos poseen un sabor dulce y
son solubles en agua, por esa razón se los llama a los glúcidos “azucares”.
Los glúcidos se clasifican por números de monómeros: los monosacáridos, los
disacáridos, los oligosacáridos y los polisacáridos; estos compuestos se encuentran
muy distribuidos en la naturaleza y forman los principales azucares como la celulosa, la
glucosa el almidón, la fécula, entre otros. Los glúcidos químicamente pueden
considerarce como polihidroxialdehídos (aldosas) o polihidroxicetonas (cetosas).
PRACTICA DE CARBOHIDRATOS .
MATERIALES:
MUESTRAS DE GLUCIDOS:
Glucosa
Fructuosa
Maltosa
Sacarosa
Almidón
Tubos de ensayo
Mechero
Gradilla
Vaso para calentar
Lugol
Reactivo de benedict
Reactivo de Fehling A y B
Papa
Yuca
Capsulas Petri
Goteros o pipetas pasteur
CARBOHIDRATOS
Practica 2

CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
4
NNKJSNXKXSSACSFD
ACTIVIDAD 1. Identificación de Azucares Reductores
Identificar la presencia de azucares reductores mediante la prueba de Fehling .
1. Colocar con la pipeta 3ml. De disolución de glucosa, maltosa, fructuosa, sacarosa y
almidón en los tubos de ensayo previamente rotulados 1, 2, 3, 4 y 5.
2. Añadir 1ml. de Fehling A y 1ml. de Fehling B. El líquido del tubo de ensayo adquirirá un
fuerte color azul.
3. Calentar el tubo al baño María o directamente en un mechero de Laboratorio.
La reacción será positiva si la muestra se vuelve de color
rojo-ladrillo.
La reacción será negativa si la muestra queda
azul, o cambia a un tono azul-verdoso.
FUNDAMENTO: Se basa en el carácter reductor de los monosacáridos y de la mayoría de los
disacáridos (excepto la sacarosa). Si el glúcido que se investiga es reductor, se oxidará dando
lugar a la reducción del sulfato de cobre (II), de color azul, a óxido de cobre (I), de color rojo-
anaranjado.
1
3
2
4
5
1
1
2
2
3
3
4
4
5
5
Muestras de glúcidos en los
tubos de ensayo.
Prueba de Fehling
Después de calentar Las
muestras de glúcidos con a
prueba de Fehling
RESULTADOS

CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
5
En las imágenes anteriores se puede observar claramente los resultados de las
soluciones de azúcares reductores, las cuales fueron: la fructosa, lactosa, glucosa y maltosa,
ya que se observa una coloración rojo ladrillo esto se debe a la concentración de azúcar en
cada solución, estableciendo que se produjo la reducción y la prueba reacciono positivamente.
De igual maneras los resultados se pueden visualizar mejor en la siguiente tabla:
TUBO
CONTENIDO
OBSERVACIÓN
RESULTADO
1
Glucosa
Precipitado rojo ladrillo, lo cual indica que si es un
azúcar reductor
+
2
Maltosa
Precipitado rojo ladrillo, lo cual indica que si es un
azúcar reductor
+
3
Lactosa
Precipitado rojo ladrillo, lo cual indica que si es un
azúcar reductor
+
4
Sacarosa
La reacción es negativa, el color se mantuvo en un
tono azul.
-
5
Almidón
La reacción es negativa, el color se mantuvo en un
tono azul.
-
DISCUSIÓN DEL RESULTADO:
El resultado de la práctica es óptimo, se conoce que la experiencia con el reactivo de
Fehling se fundamenta en el poder reductor del grupo carbonilo en las aldosas, pues tienen la
estructura química abierta necesaria para actuar como agentes reductores, y en algunas
cetosas (generalmente positiva en fructosa), lo que se evidencia con la formación de un
precipitado rojo ladrillo (óxido cuproso). Se observa que la coloración que toman los
precipitados depende de la cantidad de reactivo que se use y por tanto dan un aspecto de
buena o baja concentración.
Discutiendo los resultados positivos, obtenidos en la glucosa, maltosa y lactosa dicho
reactivo, reacciona principalmente con los aldehídos porque tienen un grupo carbonilo más
expuesto, que le da el carácter reductor, y existe la presencia del precipitado rojo ladrillo
(óxido cuproso). Es interesante discutir el resultado de la fructosa, cuya estructura es una
cetosa característica alfa-hidroxi-cetónicos, que al reaccionar con Fehling da un resultado
positivo.
Por otro lado, y refiriéndose a la sacarosa (cuyo resultado obtenido fue negativo), esto
ocurre debido a que es un azúcar constituido por una molécula de glucosa y de fructosa, tiene
un enlace entre el primer carbono de la glucosa y el segundo carbono de la fructosa, y no
queda grupos reductores disponibles. Al no ser reductor, la prueba de Fehling es negativa, y
por lo que se intuye, no posee el grupo carbonilo apto y libre, necesario como para reaccionar
con el reactivo Fehling, y a ebullición, no se observó ningún cambio.
CONCLUSIONES:
En el experimento anteriormente realizado se identificaron mediante la reacción de
Fehling los diferentes azúcares, dando como resultado una reacción positiva para la glucosa,
fructosa y lactosa, reflejado en el cambio de color de reacción ion mediante un precipitado de
color rojo ladrillo; mientras que la sacarosa reacciono de forma negativa, esto debido a que no
se produjo una oxidación por lo que se mantuvo el color azul uniforme en la reacción.

CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
6
Se analizó e identificó las características de la reacción de Fehling, que se producen ya
que utiliza como reactivo una mezcla de dos reactivos A y B en una proporción 1:1,
reaccionando con los glúcidos reductores pasando a óxido cuproso.
Se compararon las características obtenidas con la teoría establecida, ya que si se
obtuvo el precipitado rojo ladrillo en la glucosa, fructosa, lactosa porque estos tres son
azúcares reductores y negativo en sacarosa ya que esta no lo es.
ACTIVIDAD 2. Identificación de polisacáridos mediante la prueba de lugol .
La prueba de yodo es una reacción química usada para determinar la presencia o
alteración de almidón u otros polisacáridos una solución de yodo- diyodo disuelto en una
solución acuosa de yoduro de potasio que reacciona con almidón produciendo un color
púrpura; este tipo de prueba puede realizarse con cualquier producto que contenga almidón
como por ejemplo: las papas, el pan o ciertos frutos.
La prueba de yodo se da como consecuencia
de la formación de cadenas de poliyoduro a partir de
la reacción entre el almidón y el yodo presente en el
reactivo de lugol.
La amilosa y la amilopectina son
componentes del almidón pero la amilosa es de
estructura lineal, con enlaces α (1-4), que forma
hélices en donde se juntan las moléculas de yodo formando un color azul oscuro; mientras que
la amilopectina es de estructura ramificada, con con enlaces α (1-4) (1-6), que forma hélices
mucho más cortas y las moléculas de yodo son incapaces de juntarse presentando un color
intermedio entre anaranjado o amarillo.
PROCEDIMIENTO:
1. En una capsula de Petri o en un vidrio de reloj coloque un poco de solución de almidón
y agregue gotas de una solución de yodo. Repita el mismo procedimiento con un poco
de yuca y papa.
DIAGRAMA DE BLOQUES
DIAGRAMA EXPERIMENTAL
MUESTRA
LUGOL
Observar
Resultados
Solución de almidón
Yuca
Papa
Agua
Agregar unas
Gotas
Muestra
Lugol
Muestra+ lugol

CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
7
RESULTAD0
SUSTANCIA
Observaciones
Resultado
Sol. Almidón
Color azul-violeta casi negro
+
Agua
Amarillento transparente
-
Papa
Violeta muy oscuro
+
Yuca
Violeta muy oscuro
+
DISCUSIÓN DE RESULTADOS
En el primer tubo que contiene almidón al agregar dos gotas de yodo (lugol) se
observó una coloración azul negruzco esto se debe a que en esta reacción el yodo entra a
la estructura helicoidal del almidón, es decir, que los átomos de yodo se introduce entre
las espirales provocando la absorción o fijación de yodo en las moléculas del almidón
(amilosa).
En el segundo tubo, que contenía agua, se observó una coloración amarillenta
transparente, debido a que el agua no es un polisacárido que se produce la reacción con el
yodo, por lo que se torna el color del reactivo de yodo que hemos añadido.
En la tercera y cuarta muestra se observa una coloración Violeta muy oscura, por lo
que se puede determinar que ambos tienen presencia de polisacáridos, pero, se diferencian en
que la papa tuvo una tinción lenta y extensión rápida sin embargo la yuca tuvo una tinción
rápida y extensiva, esto se debe a la cantidad de almidón que posee en su composición, pero
también se debe a que este tubérculo posee en su morfología unas estructuras llamadas
aspérulas en las que el almidón puede penetrar fácilmente, gracias a estas estructuras el lugar
pudo extenderse con facilidad. No obstante la papa también evidencio una amplia extensión,
esto se debe a la cantidad de agua contenida en ya mencionado tubérculo.
1 PORCIÓN DE 100GR.
% DE ALMIDÓN
% DE AGUA
PAPA
15.9%
81%
YUCA
39.3%
58.9%
Como se observa en la tabla la yuca tiene mayor cantidad de almidón de su
composición y la papa tiene mayor concentración de agua lo que permite la dilución del lugar.
Con esto se puede visualizar lo anteriormente explicado.
RESULTADO
SOL. ALMIDÓN Y
AGUA
PAPA
YUCA
RESULTADOS

CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
8
CONCLUSIONES
1.Con la reacción del Lugol se pudo identificar de modo general polisacáridos, pero de modo
específico entre uno de ellos se encuentra el almidón como se indico en la práctica.
2.El almidón al ponerse en contacto con el lugol presenta una coloración violeta, esto se debe
a que cuando el lugol reacciona con las dos estructuras que forman el almidón, con la amilosa
proporciona un color azul y cuando reacciona la amilopectina con lugol proporciona un color
rojo y la combinación de estos dos colores nos proporciona el color violeta característico del
almidón.
3.En la muestra del agua con el lugol, nos dio una reacción negativa, y como resultado una
coloración amarillenta, esto se debe a que el agua no es un polisacárido. En el agua, no se
produce una reacción con la experiencia de yodo, esto debido a que el agua no es un azúcar, y
la coloración que se presentó en nuestro tuvo, fue la del color del reactivo de lugol
(amarillento).
ACTIVIDAD 3. Efecto de la Temperatura sobre los polisacáridos .
La prueba de Benedict es otra de las reacciones de oxidación, que como conocemos,
nos ayuda al reconocimiento de azúcares reductores, es decir, aquellos compuestos que
presentan su OH anomérico libre, como por ejemplo la glucosa, lactosa o maltosa o celobiosa,
en la reacción de Benedict, se puede reducir el Cu2+ que presenta un color azul, en un medio
alcalino, el ion cúprico (otorgado por el sulfato cúprico) es capaz de reducirse por efecto del
grupo aldehído del azúcar (CHO) a su forma de Cu+.
Este nuevo ion se observa como un precipitado rojo ladrillo correspondiente al óxido
cuproso (Cu2O), que precipita de la solución alcalina con un color rojo-naranja, a este
precipitado se lo considera como la evidencia de que existe un azúcar reductor.
El reactivo de Benedict está compuesto por:
-Sulfato cúprico.
-Citrato de sodio.
-Carbonato anhidro de sodio.
La evidencia de la reacción de Benedict es
la formación del precipitado Ion Cuproso ( Cu2O).
PROCEDIMIENTO.
a. Se rotularon cuatro tubos de ensayo (A, B, C, y D) y en cada uno de ellos se vierten
2ml. De solución de almidón.
b. Los tubos B y D se sumergieron en agua a 80°C por 30minutos, cuidando que el agua
no hierva y que los tubos no se derramen; luego de esto se retiraron los tubos del
baño maría y posteriormente se dejaron enfriar.
c. En el tubo A y B, se añadieron 1ml de solución de benedict y se calentaron a baño
maría agitándolos constantemente.
d. Para demostrar que la glucosa proviene del almidón, en los tubos C y D se colocaron
de 3 a 5 gotas de lugol.

CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
9
A los lípidos se les reconoce como aquellas macromoléculas que están constituidas por
carbono, oxígeno y nitrógeno además de poder dividirse en 2 grupos, donde el denominado
lípidos compuestos también pueden poseer nitrógeno, fosforo y azufre. Estas moléculas son
hidrófobas, es decir, presentan una insolubilidad en el agua, pero resultan solubles en
disolventes orgánicos como lo puede ser la bencina, el benceno o el cloroformo.
Constituyen una base muy importante de reservas de energía en nuestro organismo en
forma de triglicéridos además de una estructural (bicapa de fosfolípidos) y reguladora
(esteroides). Entre sus diversas clasificaciones además de poder dividirse en 2 grandes grupos
como lo son los lípidos simples (que solo poseen C, O, H) y compuestos (además pueden
poseer N,P,S) también existe otra donde los clasifica como saponificables e insaponificables.
Estos lípidos saponificables son aquellos que se asemejan a las grasas y poseen enlaces
Ester permitiendo la hidrolizacion de los mismos, siendo el caso contrario en los
insaponificables que carecen de este y no puede ocurrir dicha hidrolizacion.
Acido
acétic
o
NaOH
KHSO4
CuSO4
Clorof
ormo
MATERIALES
Mecheros
Tubos de ensayo
Capsulas Petri
Goteros o pipetas pastour
Agua destilada
Ácido clorhídrico concentrado
Ácido acetico
NaOH
KHSO4
CuSo4
Reactivo de Biuret
Reactivo de Millon
Reacctivo de Prueba xantoproteica
Cloroformo
Eter
Alcohol metílico
Alcohol Isopropilico
Solucion de yodo
Reactivo de Benedic
Reactivo de Fehling A y B

CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
10
ACTIVIDAD 1. Solubilidad en Lípidos .
La característica más destacada de todos los lípidos es su solubilidad, debido a
que estos son insolubles en agua pero si son solubles en disolventes orgánicos, no
polares. Los lípidos contienen grupos
polares y cadenas alifáticas no polares.
Las moléculas con parte hidrófila y parte
hidrófoba se conocen como Anfipáticas
Dependiendo del balance hidrófobo
o Hidrófilo, las moléculas anfipáticas pueden ser: Insolubles, Solubles.
PROCEDIMIENTO
1. Se deben tomar 9 tubos de ensayos y añadir a cada tubo 2ml de cada una de
las siguientes sustancias o disolventes:
• Agua Destilada
• Ácido clorhídrico
• Ácido Acético
• Cloroformo
• Éter
• Alcohol metílico
• Alcohol isopropilico
• Gasolina
• Kerosene
2. Añadir 1ml de aceite a cada uno de los tubos. Observar y tomar nota.
RESULTADO
Sustancia Analizada
Observación
Agua Destilada
Insoluble
Ácido Clorhídrico
Solubilidad parcial, produce micelas
Ácido Acético
Insoluble
Cloroformo
Solubilidad Total.
Éter
Solubilidad Total
Alcohol metílico
Solubilidad parcial, produce micelas
Alcohol isopropilico
Solubilidad parcial, produce micelas
Gasolina
Solubilidad total
Kerosene
Solubilidad total
DISCUSIÓN DE LOS RESULTADOS
1. Agua Destilada + Aceite: En esta prueba existe una emulsión transitoria, lo cual
significa que al dejar reposar la muestra por un momento, las gotas de aceite,
de menor densidad suben y se unen entre si, formando una capa, por lo que se
observan dos capas diferenciables, la superior, formada por aceite y la inferior
por las moléculas del agua, demostrando así su insolubilidad en el agua debido
a que este es un disolvente polar.
CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
11
2. Acido Clorhidrico
3. Acido Acetico
4. Alcohol metílico
5. Alcohol isopropilico
6. Cloroformo
7. Éter
8. Gasolina
9. Kerosene
CONCUSIONES
Una característica básica de los lípidos, y de la que derivan sus principales
propiedades biológicas es la hidrofobicidad. La baja solubilidad de los lipídos se debe a
que su estructura química es fundamentalmente hidrocarbonada (alifática, alicíclica o
aromática), con gran cantidad de enlaces C-H y C-C. La naturaleza de estos enlaces es
100% covalente y su momento dipolar es mínimo.
El agua, al ser una molécula muy polar, con gran facilidad para formar puentes
de hidrógeno, no es capaz de interaccionar con estas moléculas. En presencia de
moléculas lipídicas, el agua adopta en torno a ellas una estructura muy ordenada que
maximiza las interacciones entre las propias moléculas de agua, forzando a la molécula
hidrofóbica al interior de una estructura en forma de jaula, que también reduce la
movilidad del lípido. Todo ello supone una configuración de baja entropía, que resulta
energéticamente desfavorable.
Esta disminución de entropía es mínima si las moléculas lipídicas se agregan
entre sí, e interaccionan mediante fuerzas de corto alcance, como las fuerzas de Van
der Waals. Este fenómeno recibe el nombre de efecto hidrofóbico
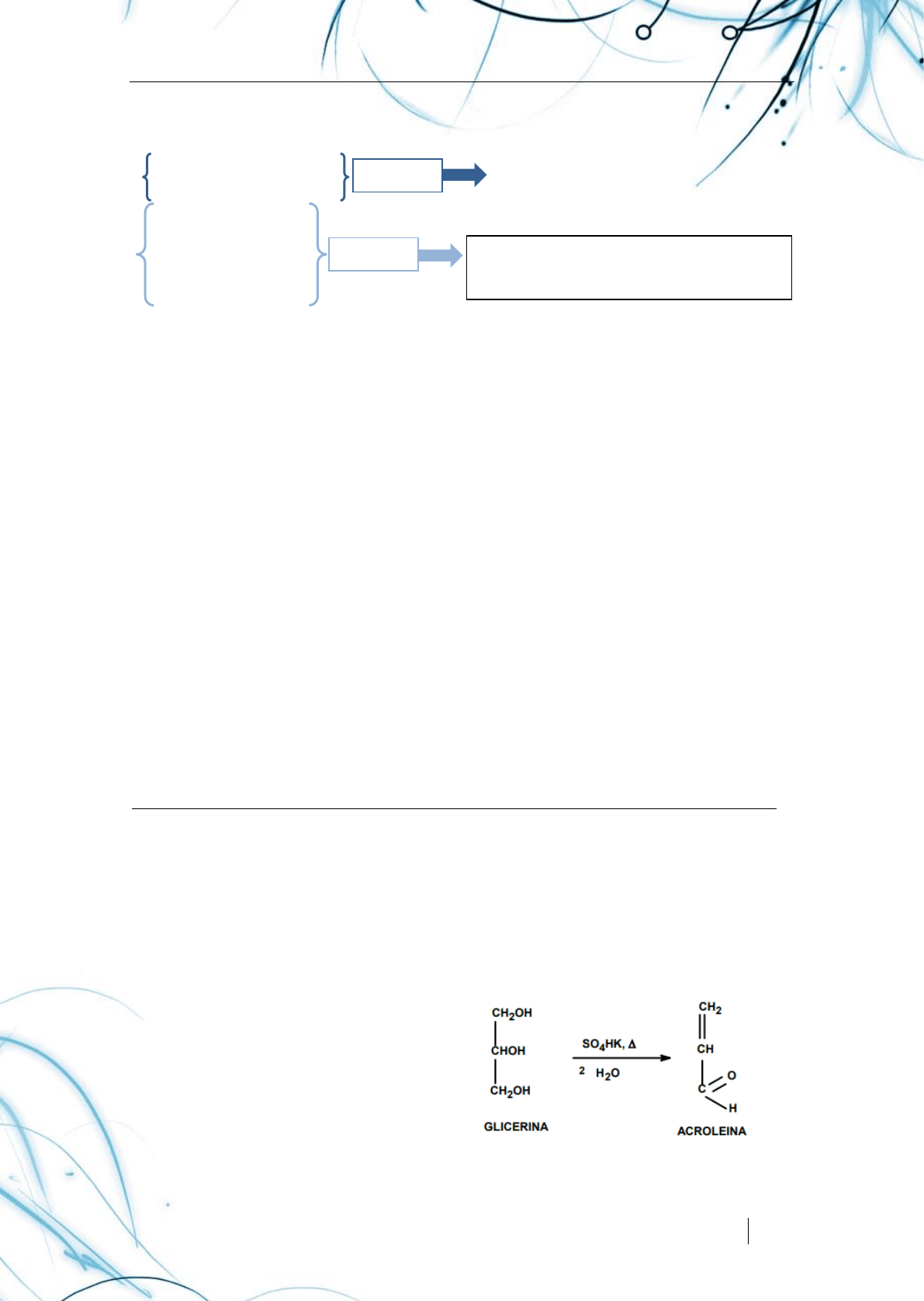
ACTIVIDAD 2. Prueba de Acroleína .
Al calentar un glicerol con bisulfuro de potasio se produce deshidratación y se
forma el aldehído de la acroleína, la cual posee un olor característico.
LA ACROLEÍNA es un líquido incoloro, transparente, inflamable y volátil a
temperatura ambiente. Miscible en agua y en disolventes orgánicos. Tiene un olor
picante y sofocante. Es un poderoso lacrimógeno. Se polimeriza fácilmente.
PRUEBA DE ACROLEÍNA La
positividad de esta reacción indica la
presencia de glicerina y se manifiesta por
el desprendimiento de vapores blancos
irritantes de olor desagradable, cuya
reacción se muestra en la siguiente figura.
+ Aceite
Presentan solubilidad total, debido a que
son sustancias
+ Aceite

CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
12
Las proteínas se reconocen como biomoléculas que se forman por cadenas lineales de
aminoácidos, tomando en cuenta sus propiedades fisicoquímicas se podrían clasificar en
simples (holoproteidos), proteínas conjugadas (heteroproteidos) y proteínas derivadas
formadas por desnaturalización de las moléculas que las componen.
Son consideradas las biomoléculas más versátiles y diversas debido a la gran cantidad
de funciones que están realizan y que resultan imprescindibles para el crecimiento del
organismo. Entre los diversos cometidos que estas realizan y como estos definen que tipo de
proteína puede ser, se encuentran: estructurales, contráctiles, homeostáticas, protectoras,
emisoras de señales, entre otras, siendo una de sus especializaciones más importantes (desde
el punto de vista catalítico), las enzimas.
Las proteínas determinaran la forma y estructura de las células además de que
dirigirán casi todos los procesos vitales, estas a su vez estarán delimitadas mayormente por su
genética (a excepción de algunos antimicrobianas de síntesis no ribosomal) o, en otras
palabras, la información genética determinara en gran medida que proteínas poseen una
célula, tejido u organismo.
Actividad 3. Identificación de aminoácidos y proteínas .
PROCEDIMIENTO
1. Tome 4 tubos de ensayo y coloque en ellos 2 ml de agua destilada y proceda a
realizar las pruebas de Ninhidrina, Biuret, Millón y Xantoprotéica.
2. Tome 4 tubos de ensayos y coloque en ellos 2 ml de la solución de glicina y
proceda a realizar las pruebas de Ninhidrin, Biuret, Millón y Xantoprotéica.
3. Tome 4 tubos de ensayo y coloque en ellos 2 ml de la solución de albumina de
huevo diluida y proceda a realizar las pruebas de Ninhidrina, Biuret, Millón y
Xantoprotéica.
PRUEBA DE LA NINHIDRINA
La ninhidrina reacciona específicamente con el grupo de a-amino de los
aminoácidos, ya sean libres o bien unidos mediante enlaces peptídicos.
La ninhidrina a pH entre 4 y 8 es un oxidante muy fuerte y siempre reacciona
con los grupos de a-amino libreando amonio, el cual se condensa con la ninhidrina
reducida y con otra molécula de ninhidrina formando un compuesto coloreado que
varía de azul a violeta púrpura.
PROTEÍNAS
Practica 3

CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
13
Procedimiento
1. Enumeramos.
2. En el tubo número uno colocamos 2ml de agua.
3. En el tubo número dos colocamos 2ml de solución de glicina.
4. En el tubo número tres colocamos 2 ml de solución de albumina de huevo.
5. Agregamos a cada tubo 10 gotas de solución de ninhidrina.
6. Mezclamos y observamos.
Resultados
• En el tubos dos que debieron presentar color azul violeta, al reaccionar con la
ninhidrina cambió casi inmediatamente a azul violeta; lo cual nos reveló la
presencia de aminoácidos.
• En el tubo tres se dio un cambio de color a celeste bajo o amarillo al reaccionar
con la ninhidrina y este demoró más tiempo en cambiar de color y la presencia
de aminoácidos fue menos que la del tubo dos.
PRUEBA DE BIURET
Existen varias pruebas para la cuantificación de proteínas de muestras
biológicas. La elección del método depende de varios factores, uno de ellos es la
cantidad de proteínas en la muestra. Por ejemplo, si la cantidad es del orden de
microgramos se recomienda utilizar la prueba de Lowry.
Por lo contrario, en muestra donde la cantidad es mayor, una prueba de
elección es la de biuret.
Fundamento
La prueba llamada biuret sirve para investigar la presencia de enlaces
peptídicos, los cuales son iones especificas entre los aminoácidos. Se basa en la
formación de sales complejas de color violeta al añadir sulfato cúprico en solución
alcalina. El complejo está formado por enlaces de coordinación, donde los pares
electrónicos proceden de los grupos aminos de los aminoácidos de cadena polipéptica.
Procedimiento
1. Enumeramos.
2. En el tubo número uno colocamos 2ml de agua destilada.
3. En el tubo dos, colocamos 2ml de solución de glicina.
4. En el tubo número tres, colocamos 2ml de albumina de huevo.
5. Añadimos a cada tubo 10 gotas del reactivo de biuret.
6. Mezclamos y observamos.

CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
14
Observaciones
• En el primer tubo pudimos observar que cambio a un color celeste claro, con
textura.
• En el tubo dos observamos que pudo cambiar a color azul con blanco con más
espumas.
• En el tercer tubo observamos que cambio a color lila claro sin espumas, este
cambio a lila ya que es aquel que contiene albumina de huevo, debido que
contiene enlaces peptídicos.
PRUEBA DE MILLÓN
La reacción es debida a la presencia del grupo hidroxifenílico (-C6H4OH) en la
molécula proteica. Cualquier compuesto fenólico no sustituido en la posición 3,5,
como la tirosina, fenol y timol, dan positiva la reacción. El mecanismo de la reacción es
poco conocido, posiblemente se deba a la formación del complejo oxido de mercurio y
fenol.
Procedimiento:
1. En un tubo de ensayo deben colocarse dos ml de la sustancia problema
2. Se colocan 4 gotas de Reactivo de Millón (Preparación: Hg y HNO3 En una
proporción de 1:3, diluir con 2 volúmenes de agua la solución resultante.
PRUEBA XANTOPROTEICA
Es una reacción que reconoce los aminoácidos que poseen el grupo bencénico
(tirosina,fenilalanina, triptófano). Las proteínas que tienen en su composición estos
aminoácidostambién darán la reacción. La positividad se reconoce por la aparición de
un coloramarillo o verde debido a la formación de nitrocompuestos.
RESULTADOS
SUSTANCIA
ANALIZADA
PRUEBA REALIZADA
Ninhridina
Biuret
Millón
Xantoprotéica
Agua destilada
Azul celeste
Azul claro
Translucido
Translucido
Glicina
Azul purpura
Celeste
Translucido
Translucido
Albúmina
Purpura suave
Violeta
Rojo, muy
suave
Amarillo
Conclusiones
• Las proteínas están enlazadas con enlaces peptídicos, disulfuros puentes de
hidrógeno de la cadena carbonada.
• Las fuentes dietéticas de proteínas incluyen carne, huevos, soya, granos,
leguminosas y productos lácteos tales como queso o yogurt. Las fuentes

CARBOHIDRATOS, LIPIDOS Y PROTEINAS
Laboratorio de Biología II
15
animales de proteínas poseen los 20 aminoácidos. Las fuentes vegetales son
deficientes en aminoácidos y se dice que sus proteínas son incompletas. Por
ejemplo, la mayoría de las leguminosas típicamente carecen de cuatro
aminoácidos incluyendo el aminoácido esencial metionina, mientras los granos
carecen de dos, tres o cuatro aminoácidos incluyendo el aminoácido esencial
lisina.
• Las proteínas constituyen una de las moléculas más importantes en el
organismo ya que cumplen muchas funciones
• Al realizar las diferentes pruebas con la albúmina se pudo comprobar
experimentalmente efectivamente que se trata de una proteína.
• El reactivo biuret sólo funciona para detectar la presencia de proteínas, mas no
incluye aminoácidos, puesto que el biuret reacciona con enlaces peptídicos
formados por la unión de aminoácidos propios de las proteínas.
• La reacción con la ninhidrina produce colores que sirven como base para la
cuantificación de todos los aminoácidos primarios.
Actividad 4. Identificación de proteínas .
PROCEDIMIENTO
1. Coloque 3 ml de leche o un poco de leche en polvo
diluida en agua y añada unas gotas del reactivo de
Biuret.
2. Deje reposar y bajo la capa azul de la disolución de Cu
(II) aprecie la presencia de un anillo malva que indica
la presencia de proteínas.
RESULTADOS
Esta curvatura azul, es debida a que la leche posee una enzima
llamada lactasa distribuida en 26gr de proteína por cada 100 gr de
leche.
DISCUSIÓN DE RESULTADOS:
Observamos que la reacción de Biuret fue positiva con la solución de
caseinato. Por este motivo se formó una especie de anillo azul en la superficie de la
leche indicando la presencia de enlaces peptídicos y por ende la de proteínas.
Este documento contiene más páginas...
Descargar Completo
reporte de carbohidratos, lipidos y proteinas.docx
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Descargar
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.