
MODULO 1: Estructura y función de las macromoléculas biológicas:
1: Concepto de célula. Generalidades de la organización estructural y funcional de las células.
Definición de célula eucariota y procariota.
Todos los seres vivos son sistemas altamente complejos y ordenados que tienen un
metabolismo en constante intercambio con el medio ambiente, para lograr mantener su
homeostasis.
Todos los seres vivos tienen en común, que están conformados por células.
Para que exista la vida tiene que haber agua, todas las reacciones químicas se llevan a cabo en
un entorno acuoso.
LA CÉLULA:
Es la mínima unidad estructural necesaria para que se dé la vida.
Es el lugar en donde se dan un montón de reacciones químicas posibles que permite que esa
célula este viva. Estas reacciones no ocurrirían espontáneamente en un tiempo corto, sin
embargo la célula posee una maquinaria celular que le permite que esas reacciones se den en
un plazo de tiempo finito.
● Tridimensional.
● Esta compartimentalizada.
● Es dinámica y social (intercambia materia, energía e información, sistema abierto).
● Unidad finita separada del entorno por una bicapa lipídica.
CELULA EUCARIOTA: Diferencias
CELULA PROCARIOTA: Diferencias
⇨ Mayor tamaño.
⇨ Poseen envoltura nuclear.
⇨ Poseen organelos delimitados por
membranas.
⇨ Menor tamaño.
⇨ No poseen envoltura nuclear.
⇨ No poseen los organelos delimitados
por membrana.
Similitudes:
Similitudes:
⇨ Membrana celular.
⇨ Citoplasma (entorno acuoso).
⇨ Ribosomas (complejos entre
moléculas de arn y proteínas, que
traducen el arn a proteína)
⇨ Membrana celular.
⇨ Citoplasma (entorno acuoso).
⇨ Ribosomas (complejos entre
moléculas de arn y proteínas, que
traducen el arn a proteína)
2: Contexto químico de las células. Estructuras y propiedades fisicoquímicas del agua. EDH.
Osmosis. Concepto de ácidos y bases. Definición y escala de pH. Sistemas amortiguadores.
PARA TENER EN CUENTA:
Electronegatividad: Medida de afinidad de los átomos por los electrones. Cuanto más
electronegativo, mayor afinidad por los electrones. (En la TP aumenta de izquierda a derecha y
de arriba hacia abajo).
Enlace Covalente: Enlace en el cual se comparten electrones. Es más corto que el EDH, por lo
tanto más fuerte. Cuando 2 átomos forman un enlace covalente, sus electrones de valencia se
comparten. Cuando se forma un enlace covalente entre dos átomos iguales, se dice que es un
1

enlace covalente apolar ya que ambos poseen la misma electronegatividad o una mínima
diferencia de la misma. Cuando se forma un enlace covalente entre dos átomos diferentes, se
habla de un enlace covalente polar ya que los electrones se acercan al átomo que tenga mayor
electronegatividad.
Enlace de Hidrogeno: Son atracciones electroestáticas. Es la fuerza de atracción entre un
átomo electronegativo y un átomo de H unido a un átomo electronegativo. Se genera una
fuerza de carga dipolo-dipolo.
Su enlace único es inestable (débil), pero en conjunto es estable (fuerte).
Se representa con rayitas.
Siempre hay una porción que actúa como dadora de EDH y otra como aceptora.
⇨ C neutro: unido a 4 átomos.
⇨ N neutro: unido a 3 átomos. (1 par de electrones libres).
⇨ O neutro: unido a 2 átomos. (2 pares de electrones libres).
Interacciones de Van der Walls: Interacción muy débil, existente siempre en todos los átomos
aunque estos se repelen.
PROPIEDADES FISICOQUIMICAS DEL AGUA:
⇨ Consta de 3 átomos (H,H,O).
⇨ Posee configuración tetraédrica (2 átomos en un mismo plano).
⇨ Poseen el punto de fusión, punto de ebullición, el calor de vaporización y la tensión
superficial, más elevados que otros hidruros comparables.
⇨ Las fuerzas de atracción entre las moléculas y su cohesión, son elevadas.
⇨ Las potentes fuerzas intermoleculares se dan gracias a la distribución específica de los
electrones en la molécula de agua.
⇨ El átomo de O comparte un par de electrones con cada H. El ángulo entre de enlace
H – O – H es de 104,5 y el enlace covalente H – O es de 0.0965 nm. Esta disposición de
electrones comunica a la asimetría eléctrica.
⇨ El átomo de O (+ electronegativo), tiende a atraer los electrones no compartidos del
átomo de H y deja desnudos los núcleos de H. Quedando así el O con densidad de
carga negativa y los H con densidad de carga positiva.
⇨ Es un dipolo eléctrico.
⇨ Las moléculas de agua entre si se unen mediante EDH.
⇨ En estado sólido puede unirse a 4 EDH con una molécula de agua, dos actuaran como
dadores y dos como aceptores de EDH.
⇨ Es polar.
Cualquier compuesto químico se puede clasificar según su polaridad:
Polar: Cuando hay diferencia de electronegatividad. (hidrofilicos)
Apolar: Cuando no hay diferencia de electronegatividad, o esta es muy poca
(hidrofobicos).
2

Anfipático: Posee un lado polar y otro apolar.
Los compuestos anfipáticos para solubilizarse en agua, forman estructuras que se
posicionan de tal manera que la parte polar quede en contacto con el agua y la parte
apolar quede hacia el centro, logrando así la solubilidad en agua. Formando micelas,
liposomas o también bicapas.
Propiedades coligativas:
Son las propiedades que se encuentran ligadas al soluto. Son las propiedades que solo
dependen del número de partículas y no de las propiedades químicas de esa partícula
(peb, pf, presión osmótica).
OSMOSIS:
Es el movimiento de agua a través de una membrana semipermeable (permite el pasaje de
agua pero no de soluto).
Presión osmótica: Fuerza que evita el movimiento de agua por la membrana semipermeable.
ÁCIDO:
Sustancia capaz de donar protones.
BASE:
Sustancia capaz de ceder protones.
pH:
Medida de protones. H − og[H]p = l
Ka: Constante de equilibrio para los ácidos. Cuanto más fuerte sea un ácido mayor será su Ka.
Pka: Habla de que tan fuerte es un ácido. Cuanto más fuerte sea un ácido menor será su pka.
Tampones o amortiguadores: zona de la gráfica en donde el par acido base conjugados, con
pequeñas agregaciones de H o OH, no varían o varían muy poco (pka).
3: Aminoácidos. Estructura y propiedades acido-base de los aminoácidos. Enlace peptídico.
AMINOÁCIDOS:
Todos los aminoácidos tienen en común que están formados por un grupo amino (amino
NH3+) y un grupo acido (ácido carboxílico COO-), estos se encuentran en un mismo carbono
llamado carbono alfa y a su vez a este carbono se le une un H y luego un R (radical, residuo
amioacidico), que es quien diferencia a los aá.
3

Los aá son quirales: giran en torno a un carbono quiral o asimetrico (carbono que en su
configuracion tetraedrica esta unido a 4 atomos diferentes). Son imágenes especulares no
superponibles.
La glicina es el unico aminoacido que no es quiral.
Isomeros: Compuestos quimicos con igual formula molecular, pero diferente configuracion.
Estereoisomeros: Se generan cuadno hay carbonos quirales o asimetricos. Da lugar a dos
estructuras, no superponibles, son imágenes especulares. Diferente configuracion en el
espacio.
o Para la convención de la cadena lateral, se la enumera con números o letras del
alfabeto griego. El carbono alfa es el que esta adyacente al ácido carboxílico C2 o Cα.
o Para lograr diferenciar a los isómeros se utiliza la fórmula de Fisher. Colocando una
línea vertical en donde irían los carbonos y en cada carbono un plano horizontal
perpendicular con cada átomo correspondiente.
o D (grupo amino a la derecha) y L (grupo amino a la izquierda).
o La única diferencia entre los enantiomeros es el plano
o donde desvían la luz polarizada puede ser d (dextrógira, desvía el plano de LP hacia la
derecha) o l (levógiro, desvía el plano de luz polarizada hacia la izquierda)
CLASIFICACION DE AMINOÁCIDOS SEGÚN SU CADENA CARBONADA:
⇨ Grupos R no polares alifáticos: Son hidrofobicos, apolares, alifáticos, cadena ramificada
solo hidrocarbonadas.
Los 3 a tener en cuenta son la Glicina que es la única que no tiene carbono quiral y su
cadena lateral es muy pequeña, la Prolina que posee un enlace con el grupo amino y
el R formando una estructura cíclica (da rigidez) y la Metionina que posee un azufre
(S), y a pesar de que tenga diferente electronegatividad con el C, esta diferencia es
muy pequeña y además luego hay varios enlaces C – H.
⇨ Grupos R aromáticos: Presentan una cadena lateral aromática (anillo), son
relativamente apolares (hidrofobicos). Poseen capacidad de absorbancia.
La Tirosina y el Triptofano son más apolares y poseen mayor capacidad de
absorbancia.
⇨ Grupos R no polares pero cargados: Son polares por que poseen cualquier
heteroatomo (átomo que no sea ni C ni H) como puede ser O o N que son más
electronegativos que el H, por ende ese enlace covalente esta polarizado. Pueden
formar EDH.
La Serina y la Treonina poseen un segundo grupo hidroxilo.
La Aspargina y el Glutamato poseen un segundo grupo amino.
La cisteína puede formar enlaces disulfuro.
⇨ Grupos R cargados positivamente: Grupo muy hidrofilico. Son N unidos a 4 átomos
diferentes, pierde su densidad de carga negativa quedando cargado positivamente.
La Histidina adquiere un valor fisiológico importante ya que a pH 7 puede estar
protonada o no.
⇨ Grupos R cargados negativamente: Son hidrofilicos o polares, poseen un segundo
grupo carboxílico.
4

PROPIEDADES ACIDO – BASE DE LOS AÁ:
Tanto el grupo carboxilo como el grupo amino poseen propiedades acido base, estén
ya sea formando parte del aa o en su cadena lateral. Al poseer esta propiedad el grupo
carboxilo puede estar como COO- o COOH y el grupo amino como NH3+ o como NH2.
Neutro actua como acido (dona un proton).
CURVA DE TITULACION DE LOS AMINOÁCIDOS:
En la curva de titulación se puede determinar el Pka: Medida de la tendencia de un grupo a
ceder un protón.
Solución o tampón buffer: Es una mezcla de un par acido base conjugado, permite que en
solución acuosa el pH no varié bruscamente frente al agregado de un ácido o de una base. Un
buffer es un buen buffer entre ± 1 del pka.
PI: pH isoeléctrico, es el ph en el cual la carga neta es cero.
- Cuando hay solo dos grupos ionizables se calcula como: iP =
2
pk1+pk2
- Cuando hay tres grupos ionizables se toman los valores donde la carga neta es 0 y se
divide entre 2.
4: Estructura primaria y secundaria de las proteínas: hélices alfa y láminas beta. Estructuras
superiores: terciaria y cuaternaria.
PROTEINAS: Son polímeros de aminoácidos.
CLASIFICACIÓN:
⇨ Fibrosas: Conformadas por una unidad repetitiva simple, que se ensambla en forma
fibrosa. Poseen forma de racimo, son prácticamente insolubles en agua y predomina
su estructura secundaria.
⇨ Globulares: Se encuentran plegadas de forma globular o esférica, son solubles en agua
y tienen funciones de transporte, hormonal, enzimáticas.
FUNCIONES BIOLOGICAS DE LAS PROTEINAS:
⇨ Enzimas: son toda la maquinaria celular que cataliza las reacciones químicas de los
seres vivos.
⇨ Transporte: Transportan sustancias del exterior de la celula al interior de la misma o
viceversa.
⇨ Contractiles: Por ejemplo los cilios y flagelos que les sirven a los protozooarios para
moverse.
5

⇨ Toxinas: Son mecanismos desarrollados por los organismos para defenderse, pueden
ser venenos de arañas o serpientes.
⇨ Estructurales: Las del citoesqueleto.
⇨ Hormonas: Insulina, glucagón, otras. (no son todas).
ENLACE PEPTIDICO:
Es el enlace que cumple la función de unir a dos o más restos de aá. Es un enlace covalente
entre dos aá, se forma entre la reacción de un grupo ácido carboxílico y un grupo amino del
Cα, formando un nuevo enlace covalente C – N.
Es una condensación por deshidratación, porque se condensan dos unidades en una y se
produce una pérdida de agua.
ENLACE DISULFURO:
Es un enlace covalente que se forma cuando dos grupos sulfhidrilo (SH), reaccionan para
formar un enlace disulfuro.
CONFORMACION DE LAS PROTEINAS:
Hace referencia a la estructura tridimensional, en su
estado nativo (lo que le da la capacidad de cumplir su función biológica). Se puede describir en
términos de niveles estructurales.
ESTRUCTURA PRIMARIA:
Refiere al orden que adopta cada aá en una determinada proteína,
unidos por enlace peptídico. Cada aá se nombra con las 3 primeras letras de su nombre. Se
representa en forma de collar de perlas.
ESTRUCTURA SECUNDARIA:
Es el plegamiento regular dado entre los aá cercanos a la cadena
peptídica. Plegamiento dado por interacciones débiles (EDH). Intervienen grupo amino y
carboxilo.
El carbono alfa puede establecer dos ángulos de torsión con los enlaces peptídicos antiguos Phi
( Cα – N) Psi (Cα – C), ambos ángulos en la estructura son iguales.
Se pueden encontrar:
6

ESTRUCTURA TERCIARIA: Habla de toda la conformación tridimensional de la proteína. Refiere
al modo en que la cadena polipeptidica se pliega o se curva para formar la estructura plegada o
compacta de las proteínas fibrosas o globulares. Aproxima regiones distantes de una misma
proteína.
ESTRUCTURA CUATERNARIA
: Se da siempre que exista más de una cadena polipeptidica,
refiere al ordenamiento de estas. Solo algunas proteínas la poseen. Es la intersección de las
cadenas mediante enlaces disulfuro (covalentes) y EDH, Van der Walls, interacciones iónicas
(no covalentes).
Homotetrameros: 4 monómeros iguales, unidas con estructura cuaternaria especifica.
Heterotetrameros: 4 monómeros diferentes, unidos con estructura cuaternaria especifica.
DESNATURALIZACION:
Es la perdida de las estructuras primarias, secundarias, terciarias y cuaternarias si las hay de
una proteína (estructura tridimensional), que ocasiona la perdida de actividad biológica. La
desnaturalización se puede dar por aumento de la temperatura, agitación, cambios de ph,
solubilidad, otras.
5: Enzimas. Definición de enzima. Cinética química. Complejo enzima – sustrato y mecanismos
de acción enzimática. Termodinámica de las reacciones catalizadas por enzimas. Conceptos
básicos de cinética enzimática: ecuación de Michaelis-Ment.
ENZIMAS: (98% proteínas – 2% ARN)
⇨ Son catalizadores biológicos (aceleran la velocidad en los procesos).
⇨ Son mayoritariamente proteínas especializadas, que tienen función catalítica,
provocando una alteración en la velocidad de la reacción química.
⇨ Son específicas para una determinada reacción y casi siempre actúan sobre un único
sustrato o un grupo muy reducido de ellos.
⇨ Para su acción es necesario condiciones (fisiológicas) de pH y temperatura específicos.
⇨ No se consumen durante la reacción.
Nomenclatura:
- Nombres particulares: asignados por su descubridor.
- Nombres sistemáticos: Consta de 3 partes:
o Sustrato preferente.
o El tipo de reacción que cataliza la E.
o Terminación “asa”.
- Código de la comisión enzimática: El nombre es el código numérico, el cual va
encabezado por las tres letras EC, seguidas de 4 números separados por puntos.
o El primer número indica a cuál de las 6 clases pertenece la E:
1) Oxidoreductasas: Transfieren electrones.
2) Transferasas: Transfieren grupos.
3) Hidrolasas: Reacciones de hidrolisis (transferencia de grupos al H2O)
4) Liasas: Adhesión de grupos iguales o formación de doble enlace de grupos.
5) Isomerasas: Transformación de grupos dentro de una molécula.
7

6) Ligasas: Formación de enlaces C-C, C-S, C-O y C-N, por reacciones
acopladas al ATP.
Sustrato: Sobre quien actúa la enzima.
Sitio activo: Es la región específica de la E, donde se une el S. Esta revestida con residuos de aá.
En el se encuentra:
- Sitio de unión: Está formado por aá, se encuentra en contacto directo con S. (le da la
especificidad a la E)
- Sitio catalítico: Está formado por aá que se encuentran implicados propiamente en la
reacción.
Características:
o Ocupa una porción pequeña en la proteína.
o Es una entidad tridimensional, lo que permite que se acomode muy bien al S. Lo
acomoda interaccionando químicamente con ese S por medio de EDH, fuerzas de Van
der Walls, enlace covalente (poco), interacciones dipolo dipolo, interacciones
hidrofobicas, interacciones iónicas (atracción y repulsión).
o En general tienen carácter apolar y tienen ciertos residuos polares (óptimamente
localizados).
o La unión del S depende de una disposición definida de átomos en el SA. El S para lograr
acomodarse bien, debe colocarse en la orientación adecuada. Hay dos modelos para
entender esto:
1) Modelo llave cerradura: “Hay una llave para cada cerradura”. El sitio de unión del S
puede existir en ausencia del S.
2) Modelo del encaje inducido: Puede formarse el sitio de unión al S, al unirse al S.
Cuando el S se une a la E hay un cambio conformacional de la E, (se adecua).
COOFACTORES Y COENZIMAS:
Existen E que además de sus residuos amioacidicos requieren de otros componentes químicos.
Estos son los cofactores y las coenzimas.
El cofactor puede ser 1 o varios iones inorgánicos. También pueden adquirir una molécula
orgánica o metal orgánica denominada coenzima. Las coenzimas actúan como transportadores
transitorias de grupos funcionales específicos: FAD, NAD.
Algunas E requieren tanto de coenzima como de 1 o más cofactores.
Una E unida covalentemente a un cofactor o a una coenzima se denomina grupo prostético.
Una E completa y activa se denomina holoenzima.
8

MODO DE ACCION DE LAS ENZIMAS:
- ∆G: Energía libre en el proceso de la reacción.
- ∆G°: Variación de energía estándar bioquímica como ocurre en los sistemas biológicos.
- ∆G≠: Variación de la energía de activación de la reacción química.
- Un equilibrio favorable no indica que la conversión de S → P sea rápida.
- Hay que superar la barrera energética “colina”, para que se dé la reacción.
- Estado de transición: Estado en el cual la caída hacia S o P son igualmente probables
(momento fugaz).
- Energía de barrera:
⇨ Energía requerida para: alineamiento de grupos de reactivos. Formación de
cargas inestables transitorias. Rodamientos de enlaces. Son requeridos para
que se de la reacción.
⇨ Es la diferencia entre los niveles de energía basal y el estado de transición.
⇨ A un aumento de ∆G≠ disminuye la velocidad.
⇨ De no existir la barrera, las reacciones revestirían espontáneamente.
CINÉTICA ENZIMÁTICA:
Determina la velocidad de las reacciones catalizadas.
9

FACTORES QUE AFECTAN LA CINETICA ENZIMATICA:
⇨ pH: Porque la E puede perder su actividad biológica al desnaturalizarse. Además las E
al poseer grupos ionizables en las cadenas laterales de sus aá, los cuales sus cargas
varían según el pH, como la conformación de las proteínas depende en parte de sus
cargas eléctricas, habrá un pH en el cual la conformación será la más adecuada para la
actividad catalítica. Este es el llamado pH óptimo.
⇨ Temperatura: Porque la E puede perder su actividad biológica al desnaturalizarse,
⇨ Fuerza iónica:
⇨ Inhibidores: Inhiben a una E si no se necesita de su acción.
6: Estructura de los glúcidos. Monosacáridos. Enlace glucosídico. Oligosacáridos y
polisacáridos. Glúcidos de almacenamiento y glúcidos estructurales.
GLÚCIDOS:
✔ Son polihidroxialdehidos o polihidroxicetonas.
✔ Conformados por un grupo aldehído o cetona y más de un grupo alcohol.
✔ Desde el punto de vista biológico, están relacionados con las funciones energéticas, de
reserva y estructurales, también forman parte del esqueleto de los ácidos nucleicos.
✔ Los glúcidos más simples son los monosacáridos. De condensación covalente a ellos se
forman los oligosacáridos y los polisacáridos.
✔ Dependiendo en n° de C que tengan, se encuentran en su forma cíclica.
Monosacáridos:
⇨ Son la unidad monomerica de los glúcidos.
⇨ Se nombran añadiendo la terminal “osa” al n° de C.
⇨ Según en donde se ubique el grupo carbonilo pueden ser aldosas (C1) o cetosas (C2).
⇨ Poseen uno o más carbonos quirales.
⇨ Poseen configuración D o L (Penúltimo C, si el OH esta hacia la derecha o izquierda).
⇨ Se diferencian también en d o l, según a donde desvíen el plano de luz polarizada.
Los monosacáridos poseen carbonos quirales. Lo que genera que existan estereoisomeros, por
ende enantiomeros (varían en la configuración de 1 C quiral), obteniendo dos enantiomeros y
también si hay más de un carbono quiral diasteromeros (varían en la configuración de más de
1 C quiral), son estereoisomeros que no son enantiomeros.
En los enantiomeros, la única diferencia es el ángulo hacia donde desvían la luz polarizada, sin
embargo en los diasteromeros poseen propiedades físicas y químicas diferentes.
Epimeros: diasteromeros que difieren en la configuración de 1 C quiral.
El número de estereoisomeros en los diasteromeros será de (quirales)2
n°C
10

ESTRUCTURA CICLICA:
En la ciclación se forma un enlace covalente hemiacetal o hemicetal, esto dependerá de si el
grupo alcohol reacciona con un aldehído o con una cetona. Una vez que reaccionan las
estructuras, el aldehído o la cetona desaparecen y pasa a hacer un alcohol (el carbono
carbonilico pasa a ser carbono alcohol).
Los grupos funcionales que quedan son alcoholes y el nuevo centro que se formó que es un
alcohol y un enlace éter en el mismo carbono hemiacetal o hemiacetalico, puede sufrir una
segunda reacción que es el ataque de otra molécula alcohol que sigue habiendo en los
polisacáridos y si esto ocurre, este carbono queda unido mediante dos enlaces éter a la cadena
carbonada que tenía el alcohol (al resto del polisacarido).
La formación del hemiacetal/ hemicetal, explica que los monosacáridos no sean lineales si no
cíclicos. Según en donde ataque el alcohol puede formar un ciclo de 5 (furanosa, ataca al C4) o
de 6 (piranosa, ataca al C5).
En la ciclación se crea un nuevo centro quiral que se llama carbono anomérico. Si el OH del
carbono anomérico esta hacia arriba será (β), en cambio si el OH esta hacia abajo será (α).
Los azucares pueden medirse mediante el OH a grupos fosfato.
Los azucares reductores son aquellos que tienen el OH del carbono anomérico libre, es lo que
le permitirá unirse mediante enlace glucosídico con otro glúcido.
POLISACARIDOS:
11

Funciones:
⇨ Almacenamiento: Almidón, Glucógeno.
⇨ Estructurales: Celulosa, quitina (esqueleto de insectos).
ALGUNOS GLUCIDOS IMPORTANTES:
Disacáridos:
⇨ Maltosa: Es el azúcar de malta. Se obtiene por la hidrolisis de almidón y glucógeno.
Posee dos moléculas de glucosa unidas por enlace α (1,4).
⇨ Lactosa: Es el azúcar de la leche. Se encuentra formado por la unión β (1,4) de la
D-galactopiranosa (galactosa) y la D- glucopiranosa (glucosa).
Polisacáridos:
⇨ Almidón: Conformado por la amilosa (polímero lineal de la glucosa con enlaces α
(1,4)) y la amilopectina (polímeros ramificados de glucosa con enlaces α (1,4) y en
enlaces α (1,6), en los puntos de ramificación).
⇨ Glucógeno: (polímeros ramificados de glucosa con enlaces α (1,4) y en enlaces α
(1,6), en los puntos de ramificación).
⇨ Celulosa: Polímero lineal de la glucosa con enlaces glucosidicos β (1,4). Las cadenas
extendidas que se disponen paralelas unas con otras estableciendo numerosos EDH.
(ESTRUCTURAL)
7: Ácidos grasos y triglicéridos. Estructura y propiedades físico químicas. Lípidos de las
membranas biológicas.
12

SAPONIFICACION: ácido graso + base fuerte (NaOH) → sal del ácido graso (jabón) + alcohol
(glicerina)
LÍPIDOS:
Se caracterizan por ser insolubles en H2O (por poseer largas cadenas carbonadas),
siendo por el contrario solubles en disolventes inorgánicos. Sin embargo algunos de ellos
tienen segmentos que son solubles en agua.
FUNCIONES:
⇨ Reserva de agua.
⇨ Producción de calor.
⇨ Estructural.
⇨ Reguladora.
⇨ Energética.
ÁCIDOS GRASOS:
Son los lípidos más comunes.
o Posee un grupo funcional ácido carboxílico y una larga cadena hidrocarbonada (apolar
o hidrofobica) en su radical, de entre 12 a 24 átomos de C (aprox), lo cual genera que
tenga muchos enlaces covalente apolares.
o Son moléculas débilmente anfipáticas. Porque hay claramente una región hidrofóbica
y luego existe una región polarizada pero esta parte es muy pequeña y a su vez esta
parte no tiene cargas netas, es polar simplemente y se puede ionizar en función del
pH.
o Generalmente no se encuentran solos. Si formando enlace ester (cuando reacciona
con un grupo ester) o amidas (cuando reacciona con una amina)
CLASIFICACIÓN:
✔ Saturados: No poseen doble enlace, son muy poco reactivos.
✔ Insaturados: Poseen al menos un doble enlace. Este enlace produce un quiebre en la
molécula que disminuye su capacidad al empaquetarse. Pueden ser cis o trans, en la
naturaleza son cis todos los AG.
⇨ PUNTOS DE FUSION:
- Saturados + PF que insaturados.
- A mayor n° de C + PF.
- A mayor n° de instauraciones – PF.
TRIGLICERIDOS:
Conformados por 3 ácidos grasos que pueden ser iguales o diferentes unidos
por enlace éter a una molécula de glicerol.
⇨ ACEITES: Triglicéridos que a temperatura ambiente son líquidos.
⇨ GRASAS: Triglicéridos que a temperatura ambiente son sólidas.
FUNCIONES:
⇨ Energética: de uso tardío.
13

⇨ Protección.
⇨ Aislante térmico: acumulado en tejidos adiposos.
⇨ Almacenamiento de energía.
LÍPIDOS ANFIPÁTICOS:
8: Biomembranas. Bicapa lipídica: composición, arquitectura molecular y propiedades.
MEMBRANA CELULAR:
⇨ Es la estructura que envuelve a la célula y la delimita.
⇨ Permite la comunicación con el entorno extracelular.
⇨ Tiene un grosor aproximado de 5 a 10 nm.
⇨ Compuesta por fosfolípidos (formando una bicapa), proteínas y glúcidos.
⇨ La bicapa lipídica, está compuesta por fosfolípidos posee dos cadenas
hidrocarbonadas y un grupo fosfato unido al glicerol, este último es quien le da la
polaridad.
⇨ Las cabezas de los fosfolípidos (polar), se coloca de tal manera que quede en contacto
con el agua y la parte apolar del mismo se coloca hacia el centro en contacto con el
entorno apolar.
CARACTERÍSTICAS DE LA MEMBRANA:
⇨ ES BIDIRECCIONAL, SELECTIVA Y ASIMETRICA.
⇨ Componentes: Lípidos (fosfolípidos, colesterol), proteínas y oligosacáridos en distintas
proporciones según las diversas membranas.
⇨ Es fluida: esto se debe a la composición lipídica de la bicapa, en la cual las dos
monocapas son diferentes. La monocapa externa está formada principalmente por el
fosfolípido fosfatidilcolina, mientras que en la monocapa interna encontramos
fosfatidilserina y fosfatidiletanolamina. A esta asimetría también contribuyen las
proteínas y glúcidos.
⇨ Permeabilidad selectiva: controla el paso de sustancias a través de ella. Esta
selectividad dependerá de la naturaleza de las sustancias que quieran atravesarla.
FUNCIONES DE LA MEMBRANA:
⇨ Conferir a la célula su individualidad, al separarla de su entorno.
⇨ Construir una barrera con permeabilidad selectiva, controlando el intercambio de
sustancias.
⇨ Controlar el flujo de información entre las células y su entorno.
⇨ Proporcionar el medio apropiado para el funcionamiento de las proteínas de
membrana.
MODELO DE MOSAICO FLUIDO: Da idea de que la membrana está en continuo cambio, en
continuo movimiento y que es justamente fluida. A su vez que no es únicamente una
membrana, sino que tiene proteínas (de todo tipo), colesterol, glucolipidos, lípidos y
oligosacáridos.
LÍPIDOS DE MEMBRANA:
Son fosfolípidos y colesterol.
Ambos tienen carácter antipático.
14
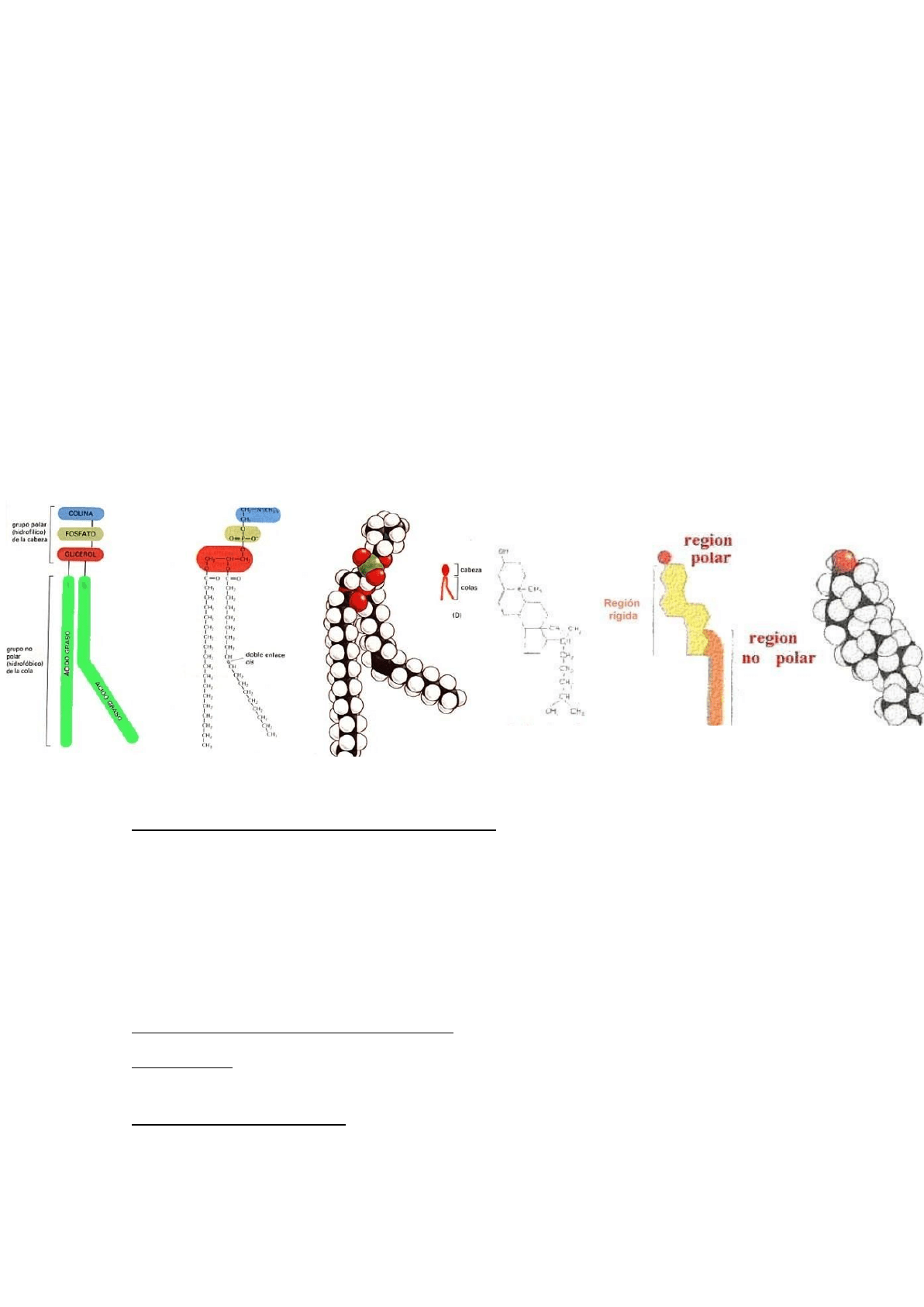
Se ubican formando una bicapa lipídica.
Se relacionan directamente con la fluidez vs/ rigidez. Según como sean los ácidos
grasos (saturados o insaturados), su punto de fusión puede variar. Por ende la fluidez
aumenta con las instauraciones, a mayores instauraciones mayor fluidez.
El colesterol son anillos fusionados (C-H), con una cola hidrocarbonada larga (apolar) y
lo único que tiene polar es un OH (cabeza polar), la cual se encontrara ubicada hacia el
interior o el exterior. Cuanto más colesterol, mas rigidez en la membrana, porque los
enlaces fusionados (núcleo esteroideo), son rígidos al estar formados por ciclos, no
tienen movimiento, dándole cierta rigidez.
Dan asimetría a la membrana.
Hay 4 tipos de fosfolípidos: fosfatidiletanolamina, fosfatidilserina, fosfatidilcorina y
esfingomelina.
La esfingomelina es la única que difiere, es químicamente similar a los fosfolípidos
clásicos, pero no pose glicerol, posee esfingosina. La esfingosina es como un glicerol
unido a un AG (Tiene 3 C, dos unidos a un OH y uno unido a un NH2), este NH2, es muy
similar al OH por que puede formar EDH, otorga polaridad al N tener un par de
electrones libres como el O.
MOVIMIENTOS DE LOS LÍPIDOS EN LA MEMBRANA:
Rotación: giro en torno a su eje.
Difusión lateral: las moléculas se difunden de manera leteral dentro de la misma capa.
Es el movimiento más frecuente.
Flip-flop: es el movimiento de la molécula lipídica de una monocapa a otra.
Energéticamente desfavorable.
Flexión: Son los movimientos producidos por las colas hidrofobicas de los fosfolípidos.
(se abren y se cierran).
FACTORES DE LA FLUIDEZ DE LA MEMBRANA:
Temperatura:
La fluidez aumenta al aumentar la temperatura, ya que los lípidos tienden a
sobrepasar su PF.
Naturaleza de los fosfolípidos:
La presencia de los lípidos insaturados y de cadena corta
favorecen el aumento de la fluidez. Porque tienen menor PF.
15
Este documento contiene más páginas...
Descargar Completo
PRIMER PARCIAL-RESUMEN.pdf
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Descargar
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.