
1
Introducción al estudio
de las
Ciencias Médicas

2
Rector
Doctor Alfonso José Gómez S.J.
Vicerrector Académico
Dr. Diego Osvaldo Fonti
Vicerrector de Economía
Magister Luis Ramón Alvarez – Chiabo
Vicerrector de Desarrollo
Dr. Jorge Orlando Pérez
Vicerrector de Medio Universitario
Licenciado Claudio José Gelmi S.J.
[email protected]du.ar

3
Coordinación y Asesoramiento pedagógico
Mónica Binimelis
Corrección de estilo - Diseño
Verónica Alvarez

4
Estimados/as estudiantes la Facultad de Medicina les da la más cálida bienvenida a la
Universidad Católica de Córdoba.
El desafío que hoy inician, será acompañado de un equipo multidisciplinario que
abordará los principales contenidos del programa de este curso ingreso.
Sabemos la importancia que tiene esta etapa en sus vidas y también las exigencias que
implica transitarla, pero estamos preparados para recibirlos/as, y guiarlos/as para que
logren el objetivo propuesto.
El gran esfuerzo que están realizando culminará en una posibilidad concreta de iniciar la
carrera de Medicina, la que cuenta con la máxima acreditación de calidad por parte de
la Comisión Nacional de Evaluación y Acreditación Universitaria CONEAU y, a nivel
MERCOSUR, con la acreditación ARCUSUR.
Durante la carrera tendrán profesores de reconocido prestigio académico a nivel
nacional e internacional y accederán a importantes ámbitos de prácticas que
garantizarán la excelencia académica y la posibilidad de desarrollo personal.
El curso de ingreso que hoy comienzan, en su modalidad presencial o examen libre,
consta de un material de estudio elaborado por docentes de la Universidad, que debe ser
aprobado en su totalidad mediante exámenes del tipo opción múltiple. Nuestra
recomendación es que además de fijar los contenidos teóricos, se ejerciten sobre este
tipo de evaluación.
Finalmente, les agradecemos la confianza depositada en nuestra facultad de Medicina
de la UCC; los esperamos con entusiasmo sabiendo que vendrán con dudas, temores y
muchas ilusiones.
Nuevamente bienvenidos/as a la Universidad Católica de Córdoba.
Hasta pronto.
Prof. Dra. Maria Alejandra Barile Prof. Dra. Analía Cudolá
Secretaria de Grado y Proyección Social Decana
Facultad de Medicina
UCC

5
QUÍMICA
Autores
Hugo D. Luján – Alicia Saura

6
Bioquímico egresado de la Universidad Católica de Córdoba.
Doctorado en Química en la Universidad Nacional de Córdoba.
Investigador Principal del Concejo Nacional de Investigaciones Científicas y
Tecnológicas – CONICET.
Director del Centro de Investigación y Desarrollo en Inmunología y
Enfermedades Infecciosas CIDIE (Instituto de CONICET).
Director del grupo de investigación en Bioquímica y Biología Molecular y
Desarrollo de Vacunas en CIDIE.
Profesor Titular de las cátedras de Química I y II de la Facultad de Medicina de
la Universidad Católica de Córdoba.
Bioquímica egresada de la Universidad Nacional de Córdoba.
Doctorado en Ciencias de la Salud en la Universidad Nacional de Córdoba.
Becaria post-doctoral del Concejo Nacional de Investigaciones Científicas y
Tecnológicas – CONICET.
Miembro investigador en el Centro de Investigación y Desarrollo en
Inmunología y Enfermedades Infecciosas CIDIE en el desarrollo de anticuerpos
monoclonales.
Profesora Adjunta de las cátedras de Química I y II de la Facultad de Medicina
de la Universidad Católica de Córdoba.
HUGO DANIEL LUJÁN
ALICIA SAURA

7
“Quienes a menudo confunden a la ciencia con sus derivaciones tecnológicas,
cometen el insensato error de juzgar lo que no admite juicio. La ciencia no es ni
buena ni mala. La ciencia es la expresión de una necesidad inherente al ser humano
y, en todo caso, está ligada a la función superior de su naturaleza inteligente: la
capacidad de crear.”
Dr. René G. Favaloro
Estimados estudiantes:
Le damos la bienvenida a la Universidad Católica de Córdoba, estaremos aquí para
acompañarlos en este camino inicial a la vida universitaria.
Esperamos que estas clases además de brindarles las herramientas conceptuales
básicas de estas materias, generen un ámbito propicio para estimular en ustedes la
curiosidad, la capacidad de crear, de plantearse nuevos interrogantes y la inquietud de
conocer.
Deseamos que esta nueva experiencia les resulte grata y enriquecedora, pero por
sobre todas las cosas anhelamos que esto sea sólo el comienzo de un largo proceso que
los lleve a convertirse finalmente en profesionales competentes, íntegros, responsables
y reflexivos, profesionales listos para enfrentarse al mundo.
¡Bienvenidos!
Dr. Hugo Daniel Luján
Dra. Alicia Saura

8
MATERIA Y ESTRUCTURA ATÓMICA
CLASE 1

9
OBJETIVOS:
Comprender los conceptos de materia y energía. Sus propiedades y
cambios de estado.
Reconocer los conceptos de sustancias puras, mezclas, elementos y
compuestos.
Diferenciar los modelos atómicos y sus aportes en el conocimiento de la
estructura atómica.
Aprender la conversión de magnitudes y la notación científica.
CONTENIDOS:
1. Materia y energía. Propiedades físicas y químicas de la materia.
2. Estados de la materia, cambios de estado.
3. Sistemas materiales, clasificación y propiedades.
4. Métodos de separación.
5. Evolución del modelo atómico. Modelos atómicos de Thompson,
Rutherford, Bohr. Principio de la incertidumbre.
6. Estructura del átomo. Número atómico y másico.
7. Isótopos y radioactividad.
8. Número cuánticos, configuración electrónica. Regla de Aufbau.
Principio de exclusión de Pauli. Regla de Hund.
10
INTRODUCCIÓN
Comenzaremos la clase dando un concepto general de QUÍMICA:
Ciencia que estudia la materia, sus propiedades, estructura, transformaciones y
leyes que rigen dichas transformaciones.
Como podemos observar, la Química centra su estudio en la materia, por lo tanto
primero debemos definir a la MATERIA como:
Todo aquello que ocupa un lugar en el espacio y posee masa.
A la variable que designa la cantidad de materia de un cuerpo se la denomina MASA
(m), cuya unidad en el SI (Sistema Internacional de Medidas, ver anexo) es el Kilogramo
(Kg). Es importante no confundirla con el PESO (P), que es una medida de fuerza.
Peso: Fuerza con que un objeto es atraído por la tierra.
P = m.g
g = Es la aceleración de la gravedad = 9,8 m.s
-2
(metros por segundo al cuadrado o m/s
2
)
Como podemos observar el peso y masa no son sinónimos, el peso es directamente
proporcional a la masa del cuerpo que se estudie y a la aceleración de la gravedad. La
fuerza de atracción de la tierra es diferente a la de otros planetas del universo, la masa
por el contrario es invariable.

11
Pregunta: Si tomamos a un astronauta cuya masa corporal es de 75 Kg y cuyo peso es
de 735,75 N (Newton) en la tierra. ¿Cuál será el peso y la masa del astronauta en la luna,
cuya gravedad es de 1,62 m.s
-2
?
La ENERGÍA se conoce y reconoce por sus efectos. Daremos como concepto general de
energía el siguiente:
Capacidad para realizar trabajo
Sabemos que existen distintos tipos de energía, como la energía potencial, cinética,
térmica, química. etc. Estas pueden intercambiarse entre sí, y según la ley de
conservación de la energía:
La energía total del universo permanece constante
Albert Einstein estableció que la materia y la energía son manifestaciones de una misma
entidad física. Esto nos demuestra que hay una relación entre ellos. La materia puede
convertirse en energía y viceversa:
E = m.c
2
Donde m corresponde a masa y c la velocidad de la luz en el vacío (300.000 Km/s). Esta
expresión nos dice que la materia y la energía son intercambiables.
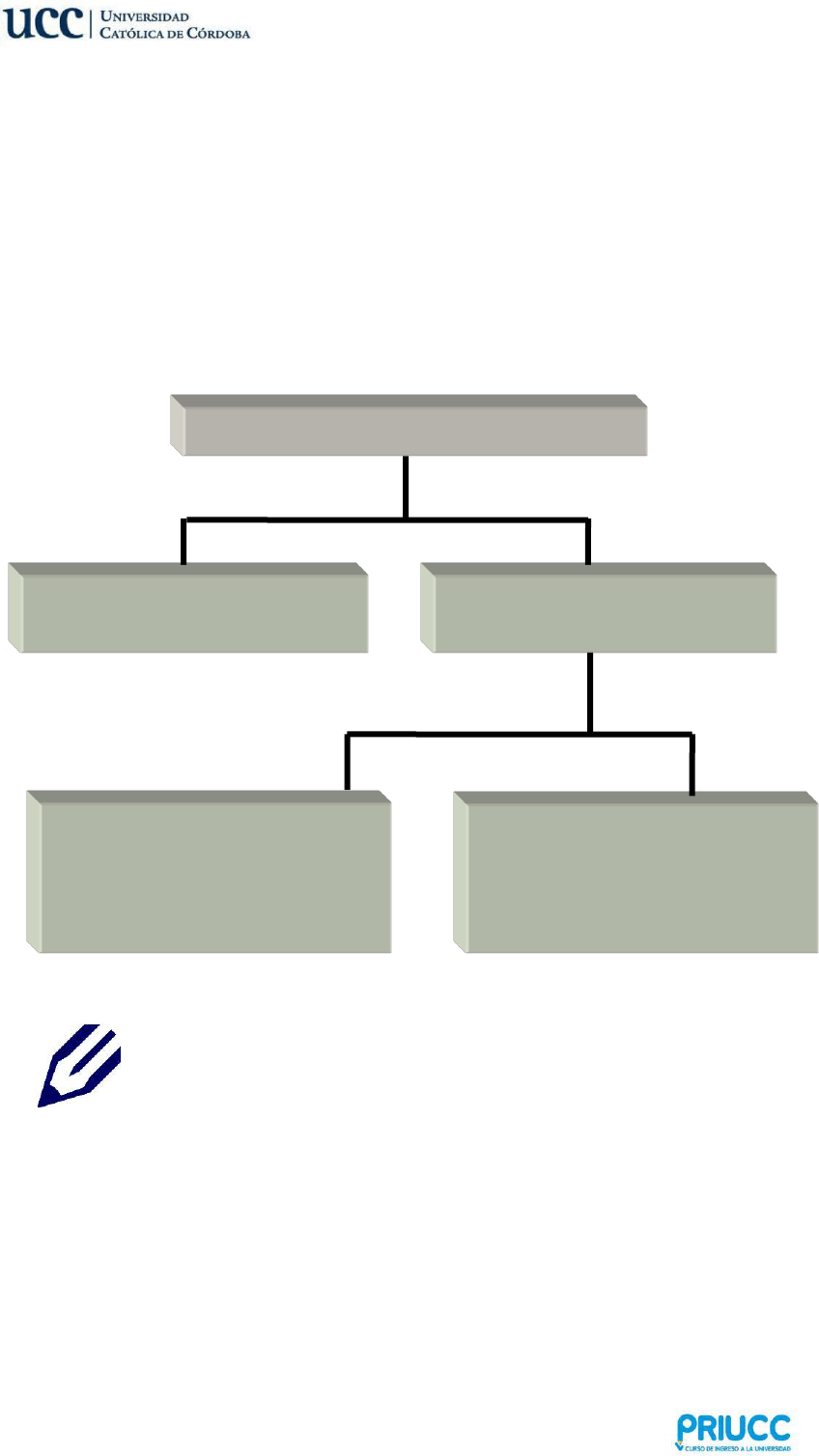
1. PROPIEDADES DE LA MATERIA
Según la cantidad de materia tenemos:
Propiedades Extensivas: son aquellas propiedades que dependen de la cantidad
(extensión) de materia. Por ejemplo la masa, el peso, el volumen, etc.
Propiedades Intensivas: son aquellas propiedades que no dependen de la
cantidad de materia. Por ejemplo la densidad, el peso específico, la temperatura,
la dureza, capacidad de un compuesto de producir una reacción química, etc.
A su vez podemos dividir a las propiedades de la materia en:
PARA PENSAR Y REFLEXIONAR
12
Propiedades Físicas: son aquellas que pueden ser medidas u observadas sin
modificar la composición y la identidad de la sustancia analizada. Ejemplos de
propiedades físicas son: la dureza, el punto de ebullición, el punto de fusión, la
densidad, etc.
Propiedades Químicas: son aquellas que solamente pueden ser observadas a
través de reacciones químicas. Una reacción química es un proceso en el cual al
menos una sustancia cambia su composición e identidad. Ejemplos de
propiedades químicas de un material combustible son la capacidad de producir
dióxido de carbono y agua, la capacidad de generar y entregar calor, etc.
Indicar si las siguientes propiedades son extensivas o intensivas:
a) Volumen.
b) Densidad.
c) Olor.
d) Punto de fusión.
e) Presión.
f) Sabor.
g) Punto de ebullición.
h) Peso.
i) Maleabilidad.
j) Viscosidad.
Propiedades de la Materia
Propiedades Extensivas
Dependen de la masa
Propiedades Intensivas
No dependen de la masa
Propiedades Físicas
Sin cambios en la composición de la
materia.
Propiedades Químicas
Con cambios en la composición de la
materia.
ACTIVIDAD
13
1.1- ESTADOS DE LA MATERIA
Se reconocen tres “Estados Físicos” o “Estados de Agregación” de la Materia. Estos son:
SÓLIDO
LÍQUIDO
GASEOSO
Estado sólido: La mayor proximidad entre las moléculas, átomos o iones que
componen un sólido caracteriza a este estado. Las partículas pueden encontrarse
altamente ordenadas en el espacio conformando una red cristalina. Sus
movimientos se limitan a vibraciones en torno a los vértices de la red en donde
se hallan situadas. Los sólidos poseen forma definida y volumen propio.
Estado líquido: Las partículas constituyentes de un líquido se encuentran más
separadas que en el estado sólido (en el orden de magnitud de un diámetro
molecular), pero no tanto como en el caso de los gases. Las fuerzas de atracción
no son muy intensas, como ocurre en un sólido, por ello estás pueden deslizarse
unas sobre otras, otorgando la capacidad de fluidez. Esto también explica el
hecho de que los líquidos no posean forma propia (se adapten a la del recipiente
que los contiene) pero sí volumen. Al encontrarse las partículas suficientemente
próximas hace de los líquidos fluidos incompresibles.
Estado gaseoso: La distancia media entre las partículas constituyentes de un gas
es igual o mayor a diez veces el tamaño de la molécula. Las fuerzas de atracción
son prácticamente nulas y las de repulsión muy grandes, lo que lleva a que un
gas sea altamente expandible y adquiera las forma y el volumen del recipiente
que lo contiene. De esto también se desprende la capacidad de fluir y su alta
compresibilidad con el aumento de la presión. Si miramos a un gas desde un
modelo de partículas, estas se encuentran moviéndose a altísimas velocidades
por todo el espacio disponible, chocando más frecuentemente con las paredes
del recipiente que las contiene que con ellas mismas. Esto se evidencia con la
presión que generan. Al entregar energía al sistema (como puede ser en forma
de calor), las mismas aumentan el número de colisiones contra la pared del
recipiente que las contiene, elevando la presión interna.
14
1.2- CAMBIOS DE ESTADO DE LA MATERIA
Fusión: es el cambio de estado sólido a líquido. Por ejemplo es lo que ocurre
cuando el hielo se derrite, pasando al estado líquido (agua).
Solidificación: Es el proceso inverso, por ejemplo el agua líquida al congelarse.
Licuación o licuefacción: Ocurre cuando se condensa vapor y pasa al estado
líquido.
Vaporización: Es cuando un líquido se transforma en vapor. este fenómeno
puede ocurrir por dos procesos diferentes:
SÓLIDO
GASEOSO
LÍQUIDO
SUBLIMACIÓN O
DEPOSICIÓN
VOLATIZACIÓN
CONDENSACIÓN O
LICUACIÓN
EVAPORIZACIÓN O
VAPORIZACIÓN
FUSIÓN
CRISTALIZACIÓN,
CONGELACIÓN O
Evaporación: Es un fenómeno que
ocurre desde la superficie del líquido y
a cualquier temperatura. En un líquido
a una determinada temperatura, las
moléculas tienen una energía cinética
promedio, pero algunas tienen más que
otras. Las que tienen mayor energía se
mueven a mayor velocidad y si alcanzan
la superficie pueden llegar a escapar
del líquido.
Ebullición: Ocurre a una determinada
temperatura para cada sustancia en
particular, dependiendo además de la
presión a la que se encuentre. El
fenómeno ocurre en todo el seno del
líquido (no sólo en su superficie), y se
produce cuando la presión de vapor del
mismo iguala a la presión exterior.
15
Volatilización: Ocurre cuando un sólido pasa directamente al estado gaseoso.
Ejemplos: la naftalina, el hielo seco (dióxido de carbono), Iodo sólido.
Sublimación: Es el proceso inverso a la volatilización, en el caso del Iodo, al enfriarse
el gas vuelve al estado sólido, también ocurre en la producción de hielo seco.
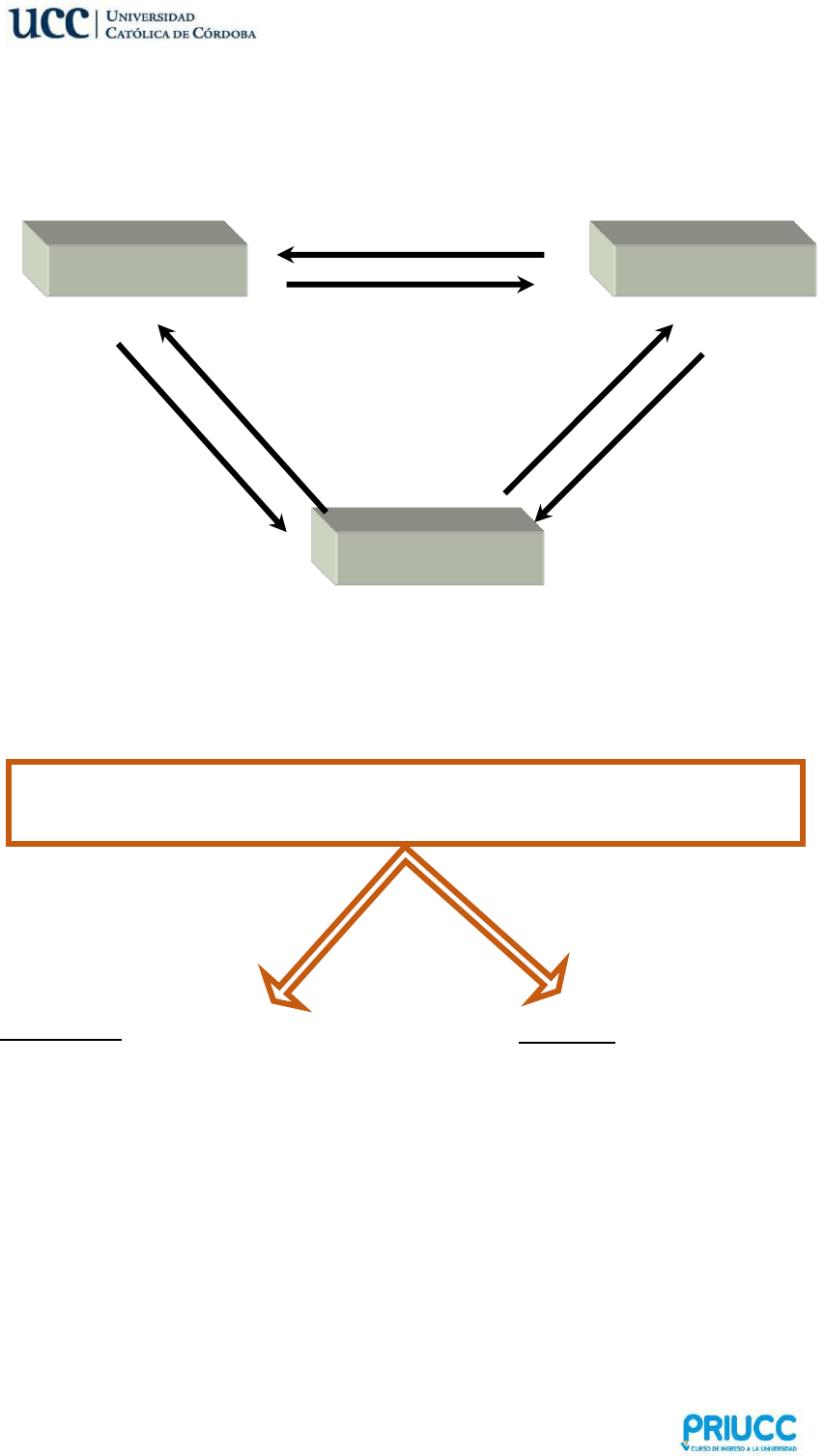
2. SISTEMAS MATERIALES
Porción limitada de materia que se separa del universo, real o imaginariamente, para
su estudio.
A los sistemas materiales los podemos clasificar de la siguiente manera:
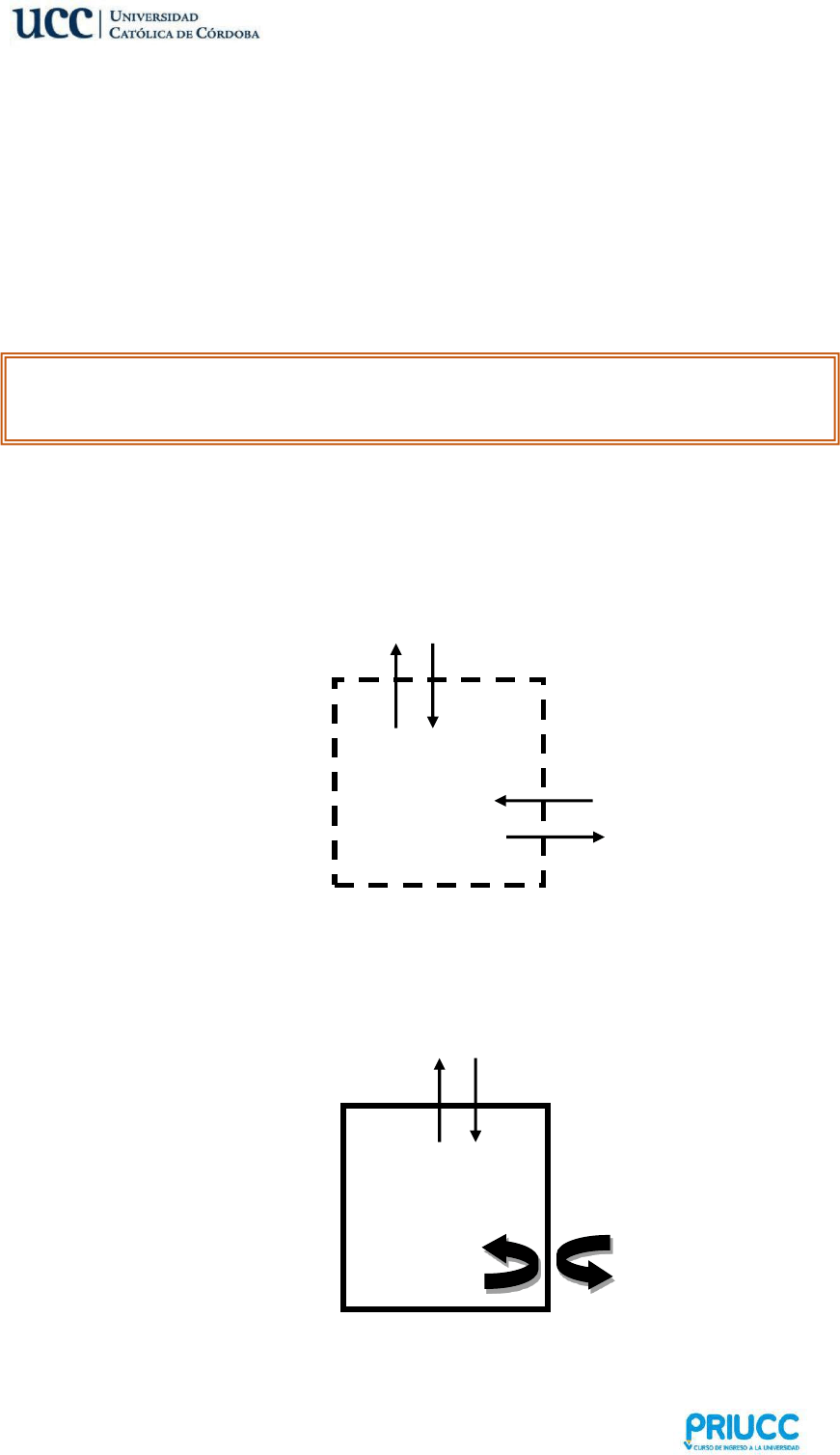
Sistemas Abiertos: aquellos donde hay transferencia de masa y energía entre el
sistema y el medio. Ejemplo: agua hirviendo en una olla.
Sistemas Cerrados: aquellos donde sólo hay intercambio de energía entre el sistema
y el medio. Ejemplo: agua hirviendo en un recipiente sellado herméticamente.
Entorno
Energía
Materia
Energía
Materia
Entorno
Energía
Materia
Energía
Materia
Este documento contiene más páginas...
Descargar Completo
Medicina_Católica_Cba.pdf
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Descargar
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.