
HIBRIDACIÓN

SCHÖDINGER
Ecuaciones Modelos Atómicos
Principio de Incertidumbre de Heisenberg
DE BROGLIE
Dualidad Onda Partícula - Ondas constructivas
ATOMO DE BOHR
Teoría que se basa en:

ENLACES COVALENTES
Teoría del Enlace
Valencia
Teoría del Orbital
Molecular
Los orbitales moleculares son los
orbitales (funciones matemáticas)
que describen el comportamiento
ondulatorio que pueden tener los
electrones en las moléculas.
Los electrones no están asignados a
enlaces individuales entre átomos,
toman un movimiento que está bajo
la influencia de los núcleos atómicos
de toda la molécula.
El orbital molecular es la suma
entre los n orbitales atómicos
constituyentes.
El átomo central en una molécula
tiende a formar pares de
electrones, en concordancia con
restricciones geométricas, según
está definido por la regla del
octeto.
Considera que el solapamiento de
orbitales atómicos de los átomos
participantes forma un enlace
químico.
Debido al traslape, es más
probable que los electrones estén
en la región del enlace.

Orbitales Moleculares σ:
Surgen de la combinación de orbitales
atómicos s con p (s-s p-p s-p p-s), tras un
solapamiento frontal de OA.
Son enlaces "sencillos" con grado de
deslocalización muy pequeño.
Se trata de orbitales con geometría
cilíndrica alrededor del eje de enlace.
Orbitales Moleculares π
Surgen de la combinación de orbitales
atómicos p perpendicuales al eje de
enlace.
Sus e- están fuertemente deslocalizados
e interaccionan fácilmente con el
entorno.
Los e- enlazantes se distribuyen como
nubes electrónicas por encima y debajo
del plano de enlace.

La Hibridación es un proceso que lleva adelante el átomo
para formar enlaces covalentes, adquiriendo mayor
estabilidad y aumentando así su capacidad enlazante
(formar un número mayor de enlaces).
Se produce por la combinación o “mezcla” de orbitales
atómicos (OA) puros para formar otros nuevos: los
orbitales híbridos (OH).
Siempre que se mezcla cierto número de OA se obtiene el
mismo número de OH. NO AUMENTA EL NÚMERO DE
ORBITALES EN EL ÁTOMO: MODIFICA LOS ORBITALES
EXISTENTES.
Los OH son equivalentes entre sí pero se distribuyen en
el espacio en dirección distinta.
TEORÍA DE LA HIBRIDACIÓN

Esta hibridación ocurre cuando se “mezcla” el OA “s” y tres
OA “p” de la capa de valencia, se generan 4 OH llamados
“sp3” (ese-pe-tres)
Ejemplo: Formación CH
4
La configuración electrónica del C: 1s
2
,
2s
2
2p
2
La capa de valencia: La estructura de Lewis
Con un par de e-
apareados y 2 e-
desapareados en su
capa de valencia,
¿podrá el C formar
este compuesto?
2s
2
2p
2
Orbital Híbrido “sp
3
”

Orbital Híbrido “sp
3
”
Configuración de
Orbitales Híbridos
sp
3
para el C
Se forman 4 OH, se dirigen a los vértices de un tetraedro
regular, formando ángulos de 109,5º entre sí.


HIBRIDACIÓN sp
3

Distribución de
las nubes
electrónicas
Modelo de bolas
y palos
Solapamiento de Orbitales
híbridos sp
3
del C con los
orbitales atómicos s del H,
forman orbitales
moleculares sigma
CH
4

ORBITAL HÍBRIDO “sp2”
Cuando se mezclan un OA “s” con dos OA “p” de la
capa de valencia, se forman tres OH “sp
2
” (ese-pe-dos).
Ejemplo: Formación AlCl
3
13
Al: 1s
2
,2s
2
2p
6
, 3s
2
3p
1
¿Podrá el Al (elemento Gpo.
IIIA) formar este compuesto
con 1 par electrónico
apareado y 1 e-
desapareados en su capa de
valencia?
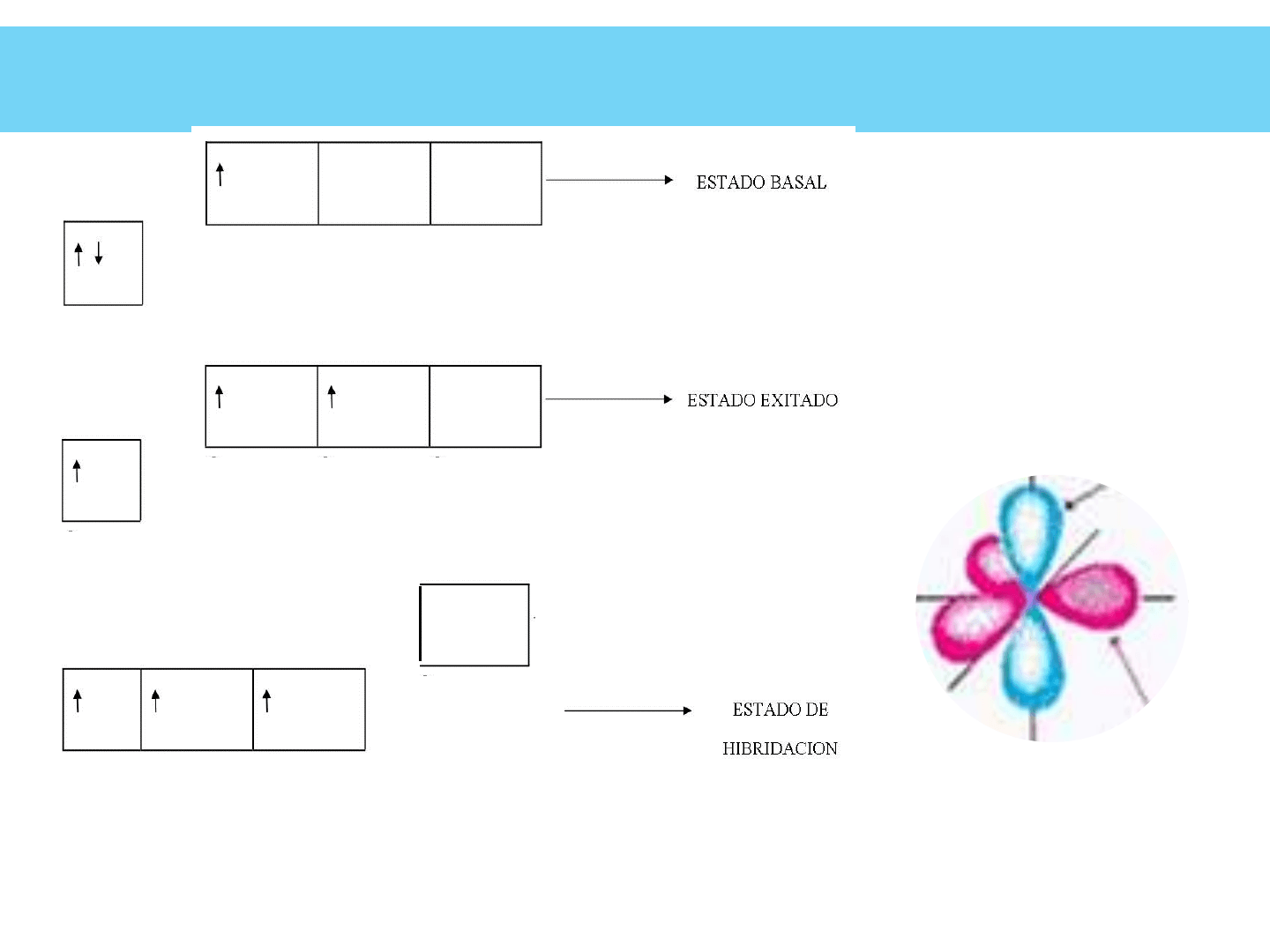
ORBITAL HÍBRIDO “sp
2
”
Orbital
Atómico
p puro
Orbital
Híbrido
sp2
Se forman 3 OH que se dirigen a los vértices de un triángulo regular, formando ángulos
de 120º, con el OA p puro perpendicular al plano de los OH
3sp
2
3sp
2
3sp
2
3p (puro)
3s 3p 3p 3p
3s 3p 3p 3p


HIBRIDACIÓN sp
2
Este documento contiene más páginas...
Descargar Completo
Autoevaluación Enlace Químico.pdf
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Descargar
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
