05/05/2017
1
QUIMICA ORGANICA 1
ALCANOS Y CICLOALCANOS
Síntesis - Reacciones
❖ Son la primera clase de hidrocarburos simples y contienen sólo
enlaces sencillos de carbono-carbono. Solo poseen carbono e
hidrogeno y no tienen grupos funcionales.
ALCANOS
❖ Los alcanos comparten muchas propiedades en común. To do s
entran en reacciones de combustión con el oxígeno para
producir dióxido de carbono y agua de vapor. En otras
palabras, muchos alcanos son inflamables. Esto los convierte
en buenos combustibles.
La importancia que tiene el estudio de los alcanos es:
nos permitirá entender el
comportamiento del
esqueleto de los compuestos
orgánicos (
conformaciones,
formación de radicales,
etc)
constituyen una de las
fuentes de energía más
importantes para la
sociedad actual (
petróleo y
sus derivados
).
ALCANOS

05/05/2017
2
Los compuestos que
contienen sólo C e H se
denominan hidrocarburos.
•Alcanos C-C
•Alquenos C=C
•Alquinos C≡C
❖Hidrocarburos cíclicos
•Ciclo alcanos
•Ciclo alquenos
•HC con puente
•HC espiros
❖Hidrocarburos alifáticos
ALCANOS
Los alcanos son hidrocarburos saturados en los cuales
todos los enlaces carbono-carbono son enlaces simples. Se
dice saturados porque contiene la cantidad máxima de
hidrógenos por carbono.
Su formula general es C
n
H
2n+2
Los cicloalcanos son alcanos en los cuales los átomos de
carbono están unidos formando un anillo.
Su formula general es C
n
H
2n
ALCANOS
❖ La principal fuente, en forma natural, de los alcanos es el
petróleo
Fuente natural alcanos

05/05/2017
3
Fuente natural alcanos
Punto de
ebullición (
0
C)
Atomos de
carbono
Productos
<30 1-4
Gas natural, metano, propano,
butano, gas licuado
30-200 4-12
Eter de petróleo (C
5,6
), ligroína
(C
7
), nafta, gasolina cruda
200-300 12-15 Queroseno
300-400 15-25
Gas-oil, Fuel-oil, aceites
lubricantes, ceras, asfaltos
>400 >25 Aceite residual, parafinas, brea
Hidrogenación de alquenos y alquinos
Síntesis de alcanos
Los alquenos reaccionan con hidrogeno en la superficie porosa de
un metal para dar alcanos
Los alquinos también reaccionan con hidrogeno ( 2 moles), de una
forma análoga a los alquenos para dar alcanos
Metal utilizado como catalizador: Pt, Pd, Ni
Cambios de energía potencial durante el avance de la reacción:
efecto del catalizador
Hidrogenación de alquenos y alquinos
Síntesis de alcanos

05/05/2017
4
Hidrogenación de alquenos y alquinos
La hidrogenación es ligeramente exotérmica, desprendiendo entre 20 y 30 kcal
por mol de hidrogeno consumido
EJEMPLO: hidrogenación 1-buteno y trans-2-buteno
ΔH⁰ = - 30,3 kcal/mol
Δ H⁰ = - 27,6 kcal/mol
Síntesis de alcanos
Reducción de haluros de alquilo
En un haluro de alquilo (RX), el C unido al Br tiene una densidad
electrónica baja por el efecto de la mayor electronegatividad del
halógeno. El metal Zn
0
dona dos electrones al carbono con lo que
se forma Zn
2+
y se rompe el enlace C-Br. El carbono que ha recibido
electrones los comparte con el hidrogeno del HBr, además se
forma ZnBr
2
como subproducto
Síntesis de alcanos
Utilizando reactivo de Grignard
Síntesis de alcanos
éter anhídrido
Ejemplo:
bromuro de sec butilo bromuro de sec butilmagnesio n-butano

05/05/2017
5
Reducción de compuestos carbonílicos
Método de Clemensen (medio acido)
Método de Wolf-Kishner (medio alcalino)
Estas reacciones reducen el grupo carbonilo a metileno.
Estas reacciones no reducen los grupos funcionales >C=C<, -CΞC- y CO
2
H
que puedan estar presentes en la molécula.
Síntesis de alcanos
hidrazina
Reducción de compuestos carbonilicos
Método de los Tioacetales (medio neutro)
Síntesis de alcanos
tioacetalditiol
Método de Wurtz
Consiste en la formación de un alcano a partir de dos haluros de alquilo iguales,
por tratamiento con sodio metálico.
Se puede dar también reacciones de Wurtz intramoleculares
Alargando la cadena
Síntesis de alcanos

05/05/2017
6
Método electrolítico de Kolbe
Alargando la cadena
Síntesis de alcanos
e
Método de Corey-House
El haluro de alquilo R-X puede ser primario o secundario.
En cambio el haluro de alquilo en el último paso (R’-X),
para que el rendimiento sea alto debe ser primario.
Alargando la cadena
Síntesis de alcanos
dialquilcuprato de litio
Ejemplos
CH
3
Br
Li/eter
CH
3
Li (CH
3
)
2
CuLi CH
3
(CH
2
)
6
CH
2
I
CH
3
(CH
2
)
7
CH
3
CH
3
CH
2
CH
2
CH
2
CH
2
Br
CuI
+
Li
CuI
+
Bromuro de
metilo
Metil litio Dimetilcuprato
de litio
Yoduro de
n-octilo
n-nonano
cloruro de sec
butilo
Bromuro de n pentilo
3-metil octano

05/05/2017
7
Pirolisis
Reacción de alcanos
Se produce cuando se calientan alcanos a altas temperaturas en ausencia de
Oxígeno. Se rompen enlaces C-C y C-H, formando radicales, que se combinan entre
sí formando otros alcanos de mayor número de C.
Combustión
Reacción de alcanos
La combustión es una oxidación rápida que transcurre a
temperaturas altas, transformando los alcanos en dióxido de
carbono y agua.
Desgraciadamente, la combustión de la gasolina y del fueloil
contaminan el aire y agotan las reservas de petróleo que son
necesarias para la fabricación de lubricantes y como materias
primas para la industria química.
La combustión completa produce dióxido de carbono (CO
2
). Este
gas ocasiona junto a otros el efecto invernadero
Halogenación
Reacción de alcanos
Los alcanos pueden reaccionar con los halógenos (F
2
, Cl
2
, Br
2
, I
2
)
para formar haluros de alquilo.
hν
ó Δ
Normalmente se necesita calor o luz para iniciar una reacción de
halogenación.
Reacciones de alcanos con cloro y bromo ocurren a velocidades
moderadas y son fáciles de controlar. Las reacciones con flúor en
general son demasiado rápidas y difíciles de controlar. El yodo no
reacciona con los alcanos o lo hace muy lentamente.

05/05/2017
8
Halogenación
Reacción de alcanos
Reacción en cadena de la cloración del metano
hν
ó Δ
Reacciones de alcanos con cloro y bromo ocurren a velocidades moderadas y son
fáciles de controlar.
Halogenación
Reacción de alcanos
La halogención de alcanos superiores es esencialmente igual a la
del CH
4
. pero puede complicarse por formación de mezclas de
isómeros
hν
ó Δ
hν
ó Δ
1°
2°
3°
27%
14%
38%
23%
REACTIVIDAD RELATIVA
3° > 2° > 1°
Ventajas Reactivo Inconvenientes
F
2
Es caro y corrosivo.
Las reacciones son
violentas
Es barato.
Cl
2
Selectividad baja.
Problemas de
polihalogenación.
Es líquido y más fácil de
manejar.
Es altamente selectivo
Br
2
Es relativamente caro.
I
2
Term odinám ic a en contr a.
Halogenación
Reacción de alcanos

05/05/2017
9
Existen varias formas para representar esquemáticamente las
conformaciones existentes por la rotación de un enlace C-C simple
LINEAS Y CUÑAS
CABALLETE
NEWMAN
ESTEREOQUIMICA
El etano tiene la característica que los dos grupos que constituyen
su estructura no están fijos en una posición.
ESTEREOQUIMICA
Etano
CH
3
CH
3
Como pasar de líneas y cuñas a Newman
LINEAS Y CUÑAS
NEWMAN
ESTEREOQUIMICA
Etano

05/05/2017
10
El giro en torno al enlace simple C-C provoca acercamientos entre
otros orbitales. Eso tiene repercusión en el contenido energético
de la molécula
ESTEREOQUIMICA
Etano
La diferencia energética entre ambas conformaciones es de 3 Kcal/mol
El giro en torno al enlace simple C-C provoca acercamientos entre
otros orbitales. Eso tiene repercusión en el contenido energético
de la molécula
ESTEREOQUIMICA
Etano
La representación estructural del propano son las siguientes:
ESTEREOQUIMICA
Propano

05/05/2017
11
El propano, tiene un perfil semejante al etano, pero con una barrera de
energía mayor.
ESTEREOQUIMICA
Propano
ESTEREOQUIMICA
Butano
La representación estructural del butano son las siguientes:
Las rotaciones alrededor del enlace central
del butano dan lugar a disposiciones
moleculares diferentes, ya que los grupos
metilo interaccionan entre si de forma
diferente en cada conformación.
ESTEREOQUIMICA
Butano

05/05/2017
12
El confórmero ANTI es de mas baja energía, en donde los dos grupos
Me están lo mas separados posibles.
ESTEREOQUIMICA
Butano
Por rotación del enlace C-C, se llega a una conformación ECLIPSADA
en las que existen dos interacciones Me-H y una interacción H-H.
La conformación GAUCHE es donde los grupos Me están separados
por 60⁰ (tensión estérica)
ESTEREOQUIMICA
Butano
Conformaciones y Estabilidades de los ciclos alcanos
Las estructuras en forma de anillos de los ciclos alcanos añaden
limitaciones a la conformación molecular. El movimiento queda mas
restringido que en moléculas aciclicas, conduciendo a repulsiones
debidas a deformaciones de los ángulos de enlace del esqueleto
cíclico.
TEORIA DE LA TENSION DE BAEYER: teoría incorrecta del siglo XIX que
suponía que los anillos de los cicloalcanos eran planos y consideraba
que sus estabilidades dependían de los que se desviara del valor del
ángulo del polígono regular del valor del ángulo tetraédrico de 109,5⁰.

05/05/2017
13
Conformaciones y Estabilidades de los ciclos alcanos
Los ciclo alcanos deben sufrir tensión angular cuando los ángulos
de enlace son diferentes a 109⁰
Conformaciones y Estabilidades de los ciclos alcanos
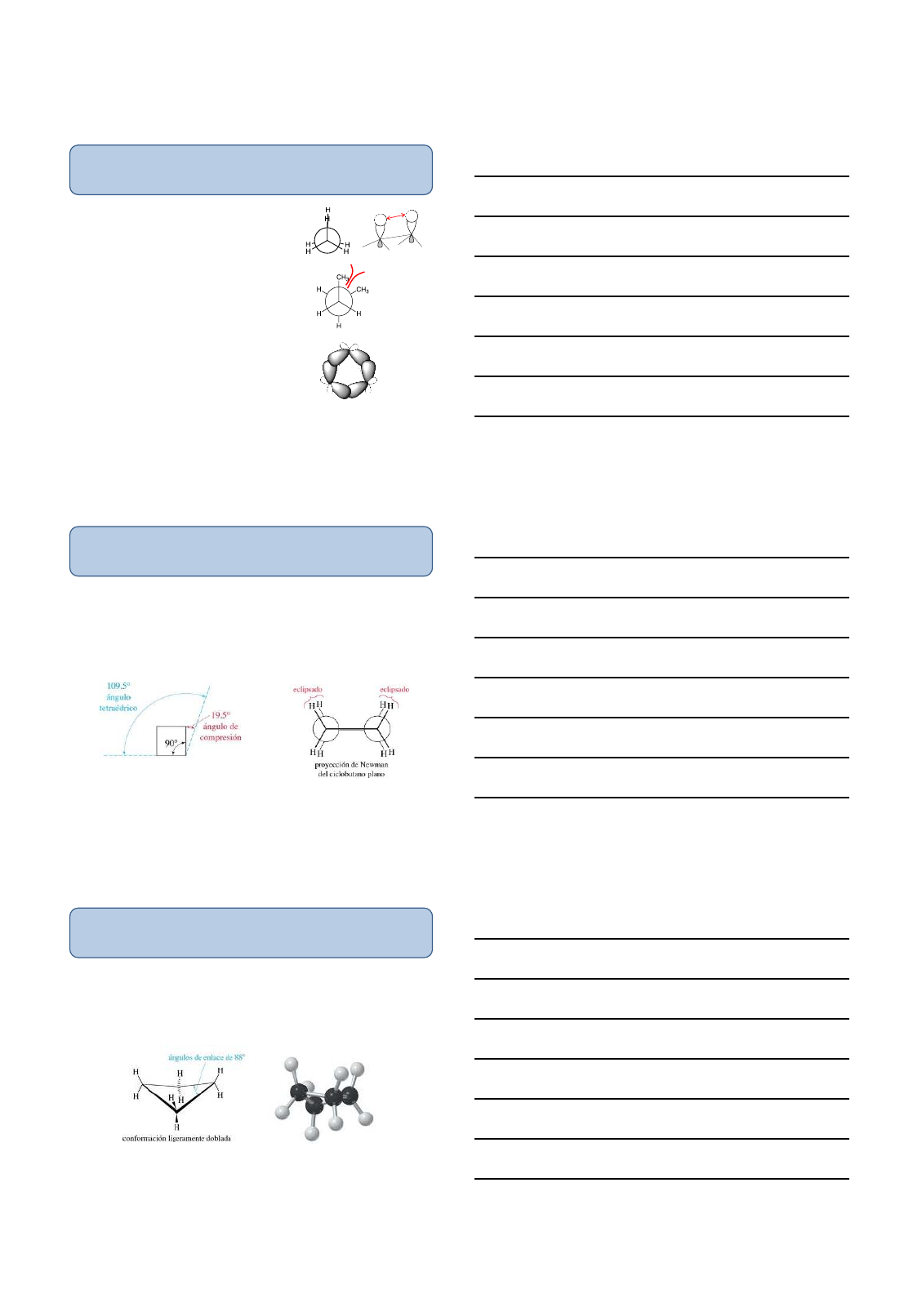
Tensión de anillo en el ciclopropano
Los ángulos de enlace en el ciclopropano se han comprimido hasta
60⁰, en lugar de 109,5⁰ correspondientes a los ángulos de enlace
de hibridación sp
3
de los átomos de carbono. Esta severa tensión
angular da lugar a un solapamiento no lineal de los orbitales sp
3
y
forma “enlaces torcidos”
Conformaciones y Estabilidades de los ciclos alcanos
Tensión de anillo en el ciclopropano
Todos los enlaces carbono-carbono están eclipsados, generando
una tensión torsional que contribuye a la tensión total del anillo.
La tensión angular y la tensión torsional en el ciclopropano hacen
que este anillo sea extremadamente reactivo.
eclipsado
eclipsado
05/05/2017
14
Conformaciones y Estabilidades de los ciclos alcanos
Tensión torsional y tensión estérica y tensión angular
Tensión torsional se debe a la repulsión de
los pares de electrones σ de enlaces que
están eclipsados
Tens ión estérica se debe a las fuerzas de
Van der Waals repulsivas que se dan entre
átomos que se ven forzados a acercarse
mas de lo que permiten sus radios
atómicos
H
H
H
H
H
H
..
..
La Tens ión angular es la tensión debida a la
compresión del ángulo de enlace (109,5⁰
para la hibridación sp
3
), hasta el requerido
para la formación del ciclo.
Conformaciones y Estabilidades de los ciclos alcanos
Tensión de anillo en el ciclobutano
La tensión del anillo de un ciclobutano plano se debe a dos
factores:
•la tensión angular debida a la compresión de los ángulos de
enlace desde el ángulo tetraédrico de 109,5º hasta 90º,
• la tensión torsional debida al eclipsamiento de los enlaces C-H.
Conformaciones y Estabilidades de los ciclos alcanos
Conformaciones del ciclobutano
La conformación del ciclobutano es tal que el anillo está ligeramente
doblado. Esta deformación de la coplanaridad proporciona un
relajamiento parcial del eclipsamiento de los enlaces.

05/05/2017
15
Conformaciones y Estabilidades de los ciclos alcanos
Conformaciones del ciclobutano
Un compuesto cíclico con 4 o más átomos de carbono adopta
conformaciones que no son planas para relajar la tensión del anillo.
El ciclobutano adopta la conformación doblada para disminuir la
tensión torsional causada al eclipsar los átomos de hidrógeno
Ciclopentano
Conformación plana
Conformaciones y Estabilidades de los ciclos alcanos
Conformaciones del ciclopentano
➢Libre de tensión angular
➢Elevada tensión torsional
La conformación del ciclopentano se dobla ligeramente.
Esta conformación plegada reduce el eclipsamiento de los grupos
CH
2
adyacentes
Conformaciones y Estabilidades de los ciclos alcanos
Conformaciones del ciclopentano
Este documento contiene más páginas...
Descargar Completo
Clases_alcanos.pdf
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Descargar
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.