
FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
1
CITOESQUELETO
El citoesqueleto es una compleja red tridimensional de filamentos proteicos que se extiende
desde la periferia del núcleo hasta la cara interna de la membrana plasmática.
En el caso de las células animales, que no poseen pared celular, el citoesqueleto va a ser quien va a
sustentar el volumen citoplasmático. A diferencia de las células vegetales que poseen pared celular y es la
encargada de realizar ese sustento.
A diferencia del endoesqueleto/exoesqueleto, el citoesqueleto es una estructura dinámica que se va a
reorganizar constantemente a medida que la célula entre en división celular, cambie de forma o en
respuesta a una señal o estimulo externo.
Asimismo, podemos decir que el citoesqueleto representa los músculos de las células, y de esa manera
será el responsable directo de diferentes tipos de movimientos a gran escala como el deslizamiento de
una célula en una superficie, el proceso de contracción muscular en el musculo esquelético, los cambios en
la morfología de algunos tipos celulares (como los glóbulos rojos), o cambios durante el desarrollo
embrionario.
Sin embargo, también en el interior de la célula ocurren diferentes tipos de movimientos en los que
participa el citoesqueleto y representa la maquinaria fundamental para:
El traslado de orgánulos, en los que participan los microfilamentos y los microtúbulos son los
encargados de realizar este transporte del endosoma temprano hacia la región del Golgi.
Participan en el movimiento de vesículas, las cuales van a ir desde el Golgi al endosoma, del Golgi a
la membrana plasmática, o en sentido retrógrado.
Participa en la segregación de los cromosomas de las células hijas durante el proceso de división
celular.
También en la mitosis y citocinesis de células animales.
Células eucariotas
Componentes del citoesqueleto en células eucariotas:
Microfilamentos
Filamentos intermedios
Microtúbulos
Si vemos una fotografía al microscopio de fluorescencia de una
célula endotelial bovina en donde se pueden observar los

FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
2
microtúbulos (verde), microfilamentos (rojo) y núcleos (azul). Los microfilamentos y microtúbulos se
extienden por todo el citoplasma de la célula, desde el núcleo hasta la membrana plasmática. En
algunos casos muchos de ellos ingresan a las prolongaciones citoplasmáticas de las células. En el caso
de los microfilamentos se concentran por debajo de la membrana plasmática y los microtúbulos se
concentran cerca del núcleo.
Células procariotas
Estas células no poseen todos estos componentes, sino que presentan
una serie de proteínas estructurales que tienen función análoga, estas
son:
FtsZ: análogo de tubulina(microtúbulos): división celular.
MreB: análogo de actina(microfilamentos): forma celular.
Crescentina: análogo de filamentos intermedios: curvatura
celular.
-El citoesqueleto es una Red tridimensional compuesta por varios tipos de proteínas.
Como dijimos anteriormente, el citoesqueleto está formado por una red tridimensional de filamentos
proteicos. Si vemos una imagen del microscopio ET de células epiteliales intestinales, podemos ver que se
destacan los componentes del citoesqueleto. En el caso de los microfilamentos ingresan por debajo de la
membrana hacia las microvellosidades, y toman contacto con la porción más apical de la microvellosidad, y
también con la membrana plasmática.
Esto lo hacen a través de proteínas
accesorias.

FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
3
Los microfilamentos tienen un espesor de aproximadamente 7nm; los filamentos intermedios de 8-12nm;
y los microtúbulos de 25nm. Esta imagen muestra la distribución de los componentes del citoesqueleto
dentro de las microvellosidades.
Los
microfilamentos son los de menor tamaño, están formados por actina como subunidad proteica.
Mientras que los
microtúbulos, que son los de mayor tamaño, están formados por subunidades de
tubulina. Los filamentos intermedios, reciben este nombre porque el tamaño es intermedio entre los
microtúbulos y los microfilamentos, están constituidos por una familia de
proteínas fibrosas.
Célula epitelial intestinal
Microfilamentos (MF)
En el caso de los microfilamentos estarán
distribuidos por toda la célula, pero se
concentrarán principalmente por debajo de la
membrana plasmática. En la zona cercana a la
microvellosidad se concentran aún más, e incluso
ingresan a las microvellosidades. Le confieren un
soporte estructural a la célula, y participan en la
motilidad de la misma.
Filamentos intermedios (FI)
Vamos a encontrar 2 tipos:
Uno de ellos forma la lamina nuclear, que
se va encontrar justo por debajo de la
membrana nuclear interna.
El otro tipo se extiende por el citoplasma
uniendo células vecinas y células a la lámina
basal, confiere resistencia mecánica a la
célula.
Microtúbulos (MT)
Son tubos largos y rectos que surgen a partir
del centrosoma que es el centro organizador
de los microtúbulos, por lo tanto, se
concentran en la región cercana al núcleo y
se distribuyen por todo el citosol.
-Muchas células mantienen su forma gracias a
los componentes del citoesqueleto.
-
Algunos tipos celulares como el caso de las neuronas, células epiteliales planas, fibras musculares
esqueléticas, o células del epitelio respiratorio mantienen su forma gracias a la presencia de los
componentes del citoesqueleto. En estos casos particulares, tiene una activa participación el soporte
estructural de los microfilamentos ya que van a impedir que las membranas plasmáticas de estas células se
relajen y que las células adquieran una forma esférica. Asimismo, en el caso de la motilidad celular también
van a participar los microfilamentos, permitiendo que cambien de forma.

FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
4
UNIONES DE ANCLAJE
Podemos ver en estas fotografías al
microscopio electrónico de transmisión
de uniones adherentes,
hemidesmosomas y desmosomas. En el
caso de las uniones adherentes las zonas
más electrodensa está dado por la
presencia de los microfilamentos, los
cuales son los que participan en este tipo
de unión. En los hemidesmosomas y
desmosomas participan los filamentos
intermedios.
DIVISIÓN CELULAR
Microtúbulos: verdes
Cromosomas: rojo y azul
En la tercera imagen (la de abajo) vemos los
microtúbulos asociándose con los
discosomas (célula vegetal), van a formar
parte del fragmoplasto durante la citocinesis
de este tipo de células. Los microtúbulos van
a traccionar los cromosomas hacia cada una
de las futuras células hijas antes de que se
produzca la citocinesis.
Otras funciones del citoesqueleto:
Interviene en procesos de endocitosis y exocitosis.
Interviene en las interacciones intercelulares.

FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
5
Participa en procesos de modulación de receptores de superficie, definiendo su conformación y
función.
Crea compartimientos favoreciendo la organización funcional.
Proteínas accesorias
Los componentes del citoesqueleto requieren de proteínas accesorias para llevar a cabo sus funciones. De
acuerdo a la función, se clasifican en:
Proteínas reguladoras: regulan procesos de alargamiento (polimerización) y acortamiento
(despolimerización).
Proteínas ligadoras: conectan los filamentos entre sí y con distintas estructuras celulares.
Proteínas motoras: sirven para la motilidad, contracción y cambios de forma celulares. También
trasladan macromoléculas, cromosomas y organelas.
-componentes del citoesqueleto (a fondo):
También nombrados
FILAMENTOS DE ACTINA.
Estos componentes del citoesqueleto se caracterizan porque se unen a proteínas de la membrana celular,
al igual que lo hacen los filamentos intermedios. A pesar de este tipo de unión de los MF a las proteínas de
membrana, participan también en procesos de movilidad celular. Para llevar a cabo estos procesos se
requiere energía contenida en forma de ATP y de proteínas que van a utilizar esta energía y transformarla
en movimiento.
De esa manera las células han desarrollado dos mecanismos básicos de movimiento:
Depende del ensamblaje y desensamblaje de MF (y MT) y es el responsable del cambio en la
forma de la célula.
Depende de proteínas motoras que utilizan la energía de nucleótidos trifosfato para caminar o
deslizarse sobre los MF (o los MT) y transportar orgánulos o vesículas.
Destacar que en el caso de los microfilamentos los nucleótidos trifosfato que se utilizan son las moléculas
de ATP y en el caso de los
microtúbulos son las moléculas
de GTP.
Para la formación de
microfilamentos se requieren
monómeros de actina G, es
decir actina bajo la forma
globular. Esta molécula de
actina tiene alta afinidad por
adenosín trifosfato (ATP) y, de
esa manera, se van a ensamblar
para formar largos polímeros
helicoidales de actina F (la
actina forma parte del
filamento, por eso la F) que ya
lleva asociada una molécula de
ADP, porque se ha producido la
MICROFILAMENTOS (MF)

FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
6
desfosforilación de ATP.
La molécula de actina tiene dos lóbulos con cuatro subunidades, y el ATP se fija en la hendidura que toma
contacto con ambos lóbulos. Además, se coordina con un catión magnesio. Los grupos amino y carboxilo
terminal se encuentran en el subdominio I de la molécula de actina.
Cuando los microfilamentos se observan al MET, se ve que se presentan como largas hebras flexibles,
retorcidas en subunidades semejantes a perlas. Por eso decimos que parecen collares de perlas retorcidas,
en donde cada perla representa una molécula de actina. Debido al enrollamiento se observa por zonas
más angostas y otras porciones más ensanchadas.
Es importante destacar que la hendidura que fija ATP siempre se orienta en la misma dirección. En el
esquema vemos como se orienta hacia la parte inferior en todas las subunidades del filamento. Este
extremo se llama extremo menos (-), y el extremo opuesto es el extremo más (+), por lo tanto, podemos
decir que el filamento de actina presenta polaridad.
Actina
Está codificada por una familia de genes altamente conservada.
Tiene su origen en células procariotas y evolucionó cuando las células eucariotas se especializaron, en
estas últimas representa la proteína más abundante.
En las células musculares representa el 10% del peso de la proteína celular total y su concentración
está entre 0,1 – 0,5 mM (mini molar)
mientras que en las microvellosidades puede
llegar a 10 mM. Esta diferencia se debe a
que en las células musculares la actina no es
la única proteína que participa en la
contracción, mientras que en las
microvellosidades la actina es uno de los
principales componentes que mantiene la
estructura de la microvellosidad.
Los microfilamentos (se encuentran como actina
F) se caracterizan por ser fibras delgadas y flexibles. Poseen 7nm de diámetro y varios um de longitud.
Dinámica del ensamblaje de actina
Estas moléculas de actina tienen una dinámica de ensamblaje para formar un microfilamento. En el
esquema se observan las esferas de actina G asociada al ATP.
En una primera etapa denominada nucleación, algunos monómeros de actina se van a asociar para
formar oligómeros estables de 3-4 subunidades que actúan como núcleo para que se alargue el
filamento.
Cuando ocurre esto comienza la segunda etapa que es la elongación, que se inicia cuando se alcanza la
concentración critica de monómeros de actina G libres. En el gráfico, las flechas negras indican la
concentración critica. Esta es la concentración mínima de subunidades de actina que se requiere para que
se inicie el proceso de elongación. Por debajo de esa concentración critica no hay elongación. Como

FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
7
puede observarse en el gráfico, la elongación es mayor en el extremo (+) que en el extremo (-); esto se
debe a que el extremo (+) del filamento tiene mayor afinidad por la actina G–ATP, por lo tanto, la
velocidad de elongación en el extremo (+) va a ser 5 – 10 veces mayor que en el extremo (-).
A medida que ese filamento que se está elongando sigue creciendo, la actina G se va a transformar en
actina F (esferas blancas). Esta etapa se denomina etapa estacionaria, los monómeros se van a
intercambiar en ambos extremos del filamento, tanto el extremo (+) como él (-), y siempre va a seguir
siendo mayor la adición en el extremo más.
Cabe destacar que la hidrólisis del ATP a ADP en el filamento, reduce la fuerza de unión entre los
monómeros y la estabilidad del polímero. Por lo tanto, la hidrólisis del ATP promueve la
despolimerización de la actina F, este proceso ocurre principalmente en el extremo (-). Podemos decir
que la actina G-ATP tiende a polimerizarse, mientras que la actina F-ADP tiende a despolimerizarse.
INTERCAMBIO ROTATORIO O MECANISMO DE CINTA RODANTE
Este mecanismo de polimerización y despolimerización de los microfilamentos se lleva a cabo
mediante un intercambio rotatorio también llamado mecanismo de cinta rodante. Es importante
destacar que la polaridad de un microfilamento está dada por la alta afinidad que tiene el extremo (+) por
la actina G-ATP, lo cual lo va a llevar a crecer mucho más rápido que el extremo menos.
En el extremo derecho del esquema tenemos moléculas de actina asociadas a ATP que van a ingresar en
el extremo (+). A medida que se van agregando los monómeros en el polímero, se va a producir la
hidrolisis del ATP generando fosforo inorgánico y moléculas de actina F-ADP. En el extremo menos se van
a comenzar a liberar estos monómeros ya que esa asociación de actina F–ADP favorece la
despolimerización. Esta actina F liberada va a intercambiar ADP por ATP generando nuevamente actina
G-ATP que va a reiniciar el proceso. Esto se conoce como mecanismo de cinta rodante.
En la formula esta simplificado el proceso. Tenemos actina G-ATP que ingresa por el extremo (+), se
polimeriza formando actina F-ADP. En el extremo (-) se despolimeriza formando actina G-ADP. En el citosol
intercambia ADP por ATP y se forma nuevamente la actina G-ATP disponible para reiniciar el proceso.

FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
8
Cuando la concentración de actina G-ATP es inferior a la concentración critica de la molécula que se
requiere en el extremo (+), directamente no va a haber polimerización. En este esquema* podemos ver
que las moléculas de actina se van agregando por el extremo (+). En la fase estacionaria las
concentraciones de actina G-ATP en ambos extremos son intermedias a las concentraciones criticas
requeridas para el crecimiento de ambos extremos. Con lo cual se siguen agregando subunidades en el
extremo (+) y hay perdidas de subunidades en el extremo (-). En esa situación la longitud de la cadena va a
permanecer constante, y las subunidades que se van agregando se van a ir desplazando a lo largo del
ligamento a medida que se forma la actina F para llegar al extremo (-), en donde se va a producir la
disociación, intercambio con ATP y se reinicia el proceso.
Este fenómeno ocurre en células móviles o en células que tienen capacidad migratoria.
*
Entonces:
Con [actina-ATP]<Cc+, no hay elongación del filamento.
En la fase estacionaria (FE) hay [actina-ATP] intermedias entre Cc+ y Cc-, continua el agregado de
subunidades en el extremo (+) con perdida en el extremo (-). En esta situación la longitud de la
cadena permanece constante y las subunidades agregadas se desplazan a lo largo del filamento
(como una cinta rodante) hasta llegar al extremo (-), donde se disocian.
Las proteínas que se asocian o se unen a un microfilamento tienen la finalidad de regular el dinamismo
de ese microfilamento.
En este esquema podemos ver como en el extremo (+) hay proteínas (verdes) y también en el extremo
(-) (azul), que se llaman proteínas estabilizadoras o proteínas caperuza. Lo que hacen es estabilizar el
filamento.
También hay algunas proteínas que
forman enlaces cruzados entre
diferentes filamentos, proteínas de
enlaces cruzados. O algunas proteínas
que pueden actuar dividiendo el
filamento en dos generando nuevas
subunidades para ser polimerizadas,
estas son las proteínas de escisión o
seccionadoras. Hay algunas proteínas
que van a regular el equilibrio que
existe entre los monómeros de actina y
los filamentos, estas van a ser las
proteínas polimerizantes, las
Proteínas asociadas a los microfilamentos

FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
9
despolimerizantes, o aquellas proteínas que modulan el intercambio de ATP por ADP sobre los
monómeros de actina G-ATP necesarios para que continúe el proceso de polimerización.
Proteínas reguladoras de la polimerización/despolimerización
Nucleación: Arp2/3
Favorecen polimerización: Profilina
Inhiben polimerización: Timosina
Degradan filamentos: Cofilina y
Gelsolina
La Arp2/3 (actin related protein) regula la
polimerización de los filamentos porque tiene
la capacidad de asociarse a una porción
cercana al extremo (+) del filamento, y va a
actuar como un nuevo nucleo de
polimerización de actina G-ATP. De esta
manera ramifica el filamento.
En el caso de la profilina, esta proteína actua
de dos maneras: una de ellas es que se asocia a la
actina F-ADP facilitando el intercambio de ADP por
ATP reponiendo el pool de actina G-ATP; la segunda
es que forma un complejo con los monómeros de
actina G-ATP promoviendo el agregado de
monómeros al extremo (+) del filamento.
Con respecto a la timosina B-4 es una
proteína bastante abundante en el citosol y tiene
mayor afinidad por la actina G-ATP que por la
actina F. por lo tanto se considera como la
principal proteína que actúa secuestrando el
complejo actina G-ATP. Entonces la timosina lo
que hace es bloquear el sitio de unión al ATP y de
esa manera evita que la molécula interactúe con
el filamento y se polimerice.
En el esquema se muestra el modelo que el papel de complementario de profilina y timosina B-4 en la
regulación de la polimerización de la actina G-ATP. Tenemos subunidades de actina G que están
complementadas con timosina. Estas se disocian y la
actina G-ATP se va a polimerizar en el filamento en
crecimiento. Ahí mismo, comienza a hidrolizarse el
ATP generando actina F que se va a comenzar a
despolimerizar. Posteriormente esa actina F se
compleja con profilina y se intercambia ADP por ATP
generando nuevamente la actina G-ATP.
Esa profilina va a actuar de dos maneras: en primer
lugar, puede hacer que lleve directamente los
monómeros de actina G-ATP al filamento y los
entregue y se disocie; o bien puede que la timosina
secuestre a la actina G-ATP haciendo que la profilina
se libere del complejo generando el pool de
subunidades listas para la polimerización.

FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
10
Existen proteínas llamadas proteínas seccionadoras que tienen la capacidad de fijarse a los filamentos de
actina y cortarlos. De esta manera se forman fragmentos cortos con nuevos extremos a través de los cuales
se va a poder reiniciar el proceso de polimerización.
En el caso de cofilina esta proteína tiene la
capacidad de unirse al extremo menos del
filamento, y lo que hace es despolimerizar el
filamento generando actina F-ADP y la cofilina
queda unida a este complejo. Posteriormente se
desprende la cofilina, se intercambia con profilina,
la cual produce el intercambio de ATP por ADP y la
molécula de profilina queda asociada a una
molecula de actina G-ATP lista para para reiniciar el
proceso de polimerización.
Puede también asociarse a la porción central,
cortando y generando nuevos fragmentos
polimerizables.
En el caso de gelsolina esta se une al extremo (+) del
filamento, lo corta y lo tapa impidiendo que ese fragmento sea
nuevamente polimerizado, es decir que en este caso la gelsolina
actua como una proteína caperuza.
Proteínas ligadoras
Formación de redes (corteza celular): Filamina
Bandas paralelas (filopodios, microvellosidades): Fimbrina
Bandas contráctiles (anillo contráctil, sarcómero): α-actinina
Proteínas motoras
Miosina (flia) (transporte de vesículas y organoides, forman el anillo contráctil de la citocinesis,
sarcómero).
Bandas o haces de actina: los filamentos se unen por puentes cruzados y se disponen en
estructuras paralelas que están muy agrupadas.
Redes de actina: los filamentos se unen por puentes cruzados con disposición ortogonal y están
empaquetados en forma laxa. Forman mallas tridimensionales.
Organización de los microfilamentos

FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
11
Haces
En las células se pueden formar 2 tipos de
haces: contráctil y paralelo, en ambos las
moléculas ligadoras van a ser las moléculas
Fimbrina:
Paralelos: La fimbrina tiene dos
dominios adyacentes (ABD) de
unión a actina y entrelaza
filamentos en haces paralelos,
estrechamente empaquetados.
Contráctiles: Los dos dominios de
fimbrina que se asocian a actina,
están separados por dímeros de α-
actinina por lo que los haces
contráctiles están más espaciados.
Tanto la fimbrina como α-actinina
tienen sitios de fijación de Ca2+.
Ejemplos de haces de microfilamentos de actina
Estereocilios o estereovellosidades
Algunos ejemplos de haces de
microfilamentos de actina son los estereocilios
o estereovellosidades, que son
microvellosidades modificadas largas e
irregulares. En la fotografía al MEB se muestra
una célula principal del epidídimo, mientras
que la fotografía al MET se muestran también
un estereocilio, pero de una célula piliforme del
oído.

FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
12
Estos estereocilios surgen
de la porción apical de las
células y poseen
pedúnculos gruesos que
se conectan por puentes
citoplasmáticos. Los tipos
de haces van a estar
distribuidos a lo largo de
toda la célula, en algunos
sectores del pedúnculo
vamos a encontrar haces
paralelos, es decir que
fimbrina es la proteína de
adhesión y se asocian a la
membrana plasmática a
través de erzina.
Mientras que los haces
contráctiles se van a encontrar al nivel de los puentes citoplasmáticos y también los vamos a encontrar en
el velo terminal, α-actinina conecta ambos dominios de fimbrina.
Los haces también se encuentran presentes en las microvellosidades, que son prolongaciones
citoplasmáticas de las células epiteliales intestinales. Son altas, uniformes y se encuentran muy juntas de
tal manera que ese epitelio incremente la superficie de absorción.
Cuando observamos una fotografía al MET podemos ver como los
microfilamentos ingresan a las microvellosidades desde la zona cortical, y
ya aparecen en forma paralela y vinculados a la membrana plasmática de
la microvellosidad.
En el siguiente esquema podemos ver que los
microfilamentos se unen entre ellos a través de
dos tipos de proteínas: fimbrina y a través de
fascina. A su vez se asocian con la membrana
plasmática a través de una proteína motora que es
la miosina I. Los microfilamentos también se
encuentran en la región cortical, que en el
esquema está representado por el vello terminal.
Se van a asociar a través de moléculas de
espectrina y a través de otro tipo de miosina que es
la miosina II; ambas moléculas van a interrelacionar
los microfilamentos con otro componente del
citoesqueleto que es el caso de los filamentos
intermedios.

FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
13
Esta fotografía muestra una ampliación de la red
terminal y también de las microvellosidades. Se
observa cómo se disponen los microfilamentos
en relación a las microvellosidades y a la
membrana plasmática. En la porción más basal
de la imagen se observan los filamentos
intermedios, y se puede ver que tienen un
espesor mucho mayor que los microfilamentos
de actina.
Haces de actina contráctiles
Los haces contráctiles
tienen un papel
fundamental en la
división citoplasmática
de las células animales,
ya que ellos son los que
van a formar el anillo
contráctil.
Redes
En este caso la filamina va a ser la molécula ligadora. La filamina es un dímero de dos subunidades
grandes, que forman una molécula flexible en forma de V y que entrelaza los filamentos de actina en
redes ortogonales.
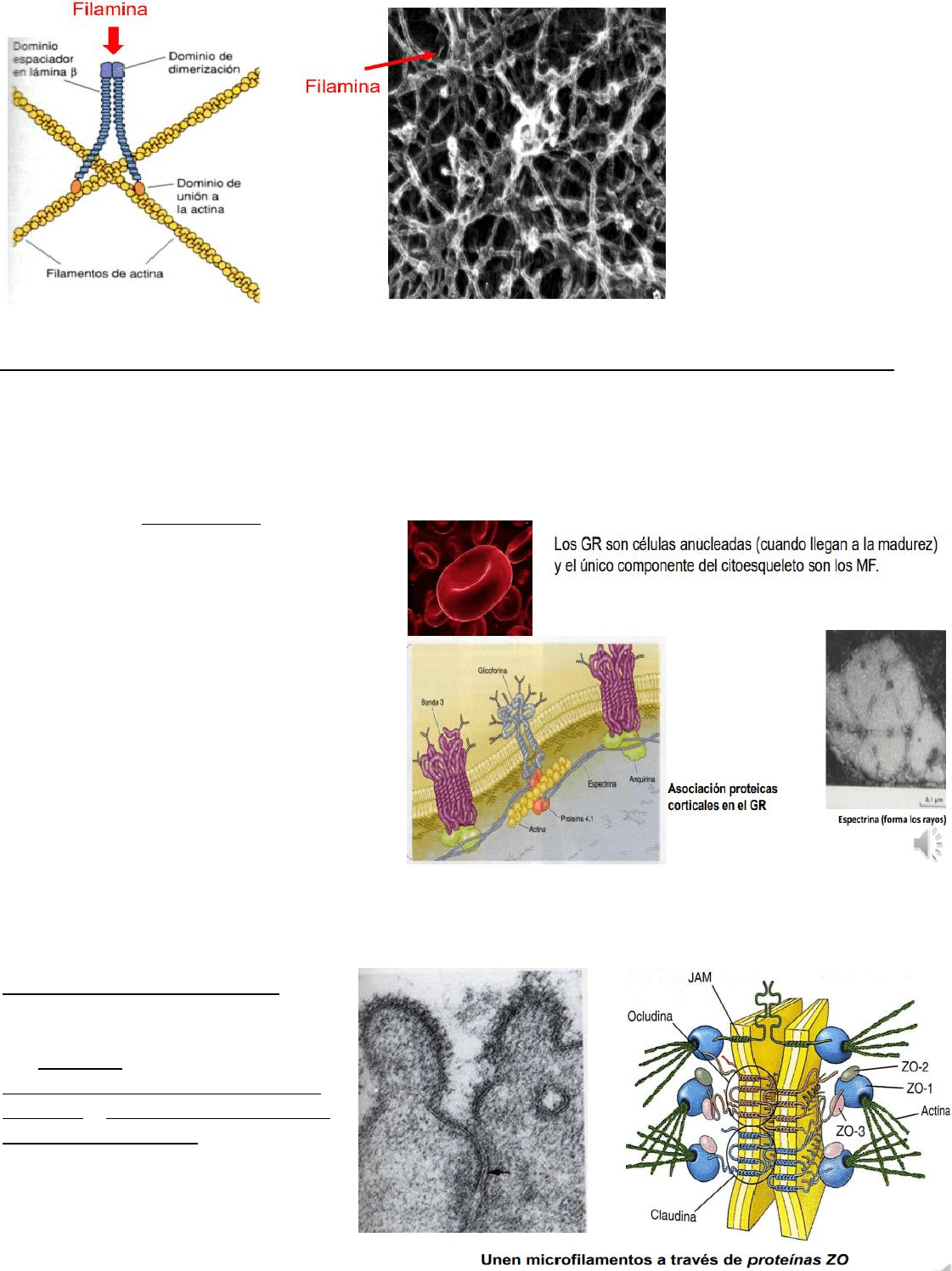
FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
14
Forma puentes cruzados entre MF formando una malla tridimensional que se ubica por debajo de la MP,
dando soporte estructural a la superficie de la célula. Esta red forma el córtex celular.
La forma de la célula depende de los MF y de las proteínas de unión que los conectan con la MP
Los microfilamentos constituyen una red tridimensional con algunas proteínas de unión que se
encuentran en el córtex celular. Esto va a determinar la forma de la célula y la interacción con otros
componentes como la superficie celular o el movimiento celular.
En el caso de los glóbulos rojos que son
células anucleadas cuando llegan a la
madurez, el único componente del
citoesqueleto que se encuentra presente son
los microfilamentos. En los glóbulos rojos la
membrana plasmática se asocia con una red
de tetrámeros de espectrina que se encuentra
entrelazada con microfilamentos cortos
asociados a una proteína 4.1. Esa red
espectrina – actina se une a la membrana
plasmática a través de anquirina, que también
tiene afinidad por una proteína
transmembrana denominada banda 3, y actina
– espectrina con una glicoforina (proteína de
membrana) a través de una proteína citosólica
4.1. La espectrina tiene una estructura en forma de rayos.
Los MF participan en las uniones de estancas y de anclaje
Uniones oclusivas (unión estanca)
En este caso podemos ver una
unión oclusiva, en el cual las proteínas
que participan en este tipo de unión son
proteínas de múltiple paso, Claudina y
ocludinas, y proteínas de un único paso
que es la proteína JAM. Estas proteínas
se vinculan en el espacio intercelular y
en el dominio citoplasmático a través de
diversas proteínas denominadas ZO se
van a vincular con los microfilamentos
de actina en donde la que las une es la

FBQF-Biología
Balmaceda Sarrulle Iñaki CITOESQUELETO
15
proteína ZO-1.
Uniones adherentes
Debajo de las uniones oclusivas se encuentran las uniones adherentes.
Es uno de los tipos de uniones de anclaje. En estas uniones el espacio citosólico es mayor; las
proteínas que se vinculan el espacio intercelular son dependientes de calcio y se denominan cadherinas
(es un dímero). Del lado intracelular se va a asociar con los microfilamentos de actina, específicamente
con α-actinina, a través de vinculina y catenina. En el esquema se muestra como a partir de las uniones
adherentes se generan los cinturones de adhesión y los microfilamentos se van a unir a estos cinturones
para formar parte y mantener la estructura de las microvellosidades.
En la fotografía al MET
se observan las
uniones oclusivas en la
región más apical, y
por debajo de
observan las uniones
adherentes y se puede
ver que el espacio
intercelular es mayor y
que prácticamente no
existe en las uniones
oclusivas.
adhesiones focales
La célula debe asociarse a la
lámina basal a través de los
hemidesmosomas y a través de las
adhesiones focales. En el caso específico
de las adhesiones focales, las moléculas
que van a vincular la célula con la lámina
basal van a ser las integrinas a través de
fibronectina. Los filamentos de actina se
encuentran formando redes, de manera
que actúa α-actinina y se va a asociar a
través de una serie de proteínas como es
vinculina, paxilina y talina a integrina
(específicamente la que conecta con la
lámina basal).
MOVIMIENTOS Y PROCESOS CELULARES
Este documento contiene más páginas...
Descargar Completo
CITOESQUELETO (imprimir).pdf
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Descargar
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.