
AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
2
¿QUÈ ES LA QUÌMICA?
La
química es la ciencia que estudia la materia, sus propiedades, su constitución
cualitativa, los cambios que experimenta y las variaciones de energía que
acompaña sus transformaciones.
MATERIA
Materia es todo aquello que tiene masa y ocupa un espacio e impresiona
nuestros sentidos.
La
masa es una medida de la cantidad de materia que hay en una muestra de
cualquier material. Cuanta mayor masa tenga un objeto, más fuerza se requerirá
para moverlo. Materia es, por lo tanto, todo lo que requiere energía para ponerse
en movimiento.
Como todos los cuerpos del universo satisfacen la definición de materia, todos
ellos son materia.
Es importante no confundir masa con peso. Peso es la fuerza con que la Tierra
atrae los cuerpos. Es variable porque depende de la gravedad y su unidad de
medida es el Newton (N).
ENERGIA
La
energía suele definirse como la capacidad de realizar un trabajo.
Ejemplos:
•Aire
•Alimentos
•Rocas
•Vidrio

AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
3
La energía química es una manifestación más de la energía. En concreto es uno
de los aspectos de la energía interna de un cuerpo y, aunque se encuentra
siempre en la materia, sólo se nos muestra cuando se produce una alteración
íntima de ésta. La mayoría de las manifestaciones energéticas tiene como origen
la energía química.
La teoría de mayor impacto en este siglo en relación a la materia y la energía,
fue la de Einstein quien postula la posibilidad de su interconversiòn.
Es decir que cualquier cuerpo de masa m posee una energía dada por la famosa
ecuación
Según esta visión del universo, masa y energía son dos caras de la misma
moneda porque como vemos, pueden interconvertirse. Este es el origen de la
gran cantidad de energía que se desprende en las reacciones nucleares
producidas en las estrellas o en las bombas atómicas.
En las reacciones químicas siempre hay intercambio de energía, pero la cantidad
de energía intercambiada en ella es muy pequeña si se lo compara con las
reacciones nucleares.
Reconocida la equivalencia entre la materia y la energía, se enuncio la
Ley de la
conservación de la masa y la energía: la cantidad combinada de materia y energía
en el universo es fija.
ESTADOS DE LA MATERIA
La materia está formada por átomos o moléculas y estos se mantienen unidos
mediante fuerzas de carácter electrostático, denominadas fuerzas
intermoleculares.
Existen dos tipos de fuerzas intermoleculares:
fuerzas de atracción y fuerzas de
repulsión. Dependiendo de la intensidad de dichas fuerzas, la materia será:
E = m c
2

AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
4
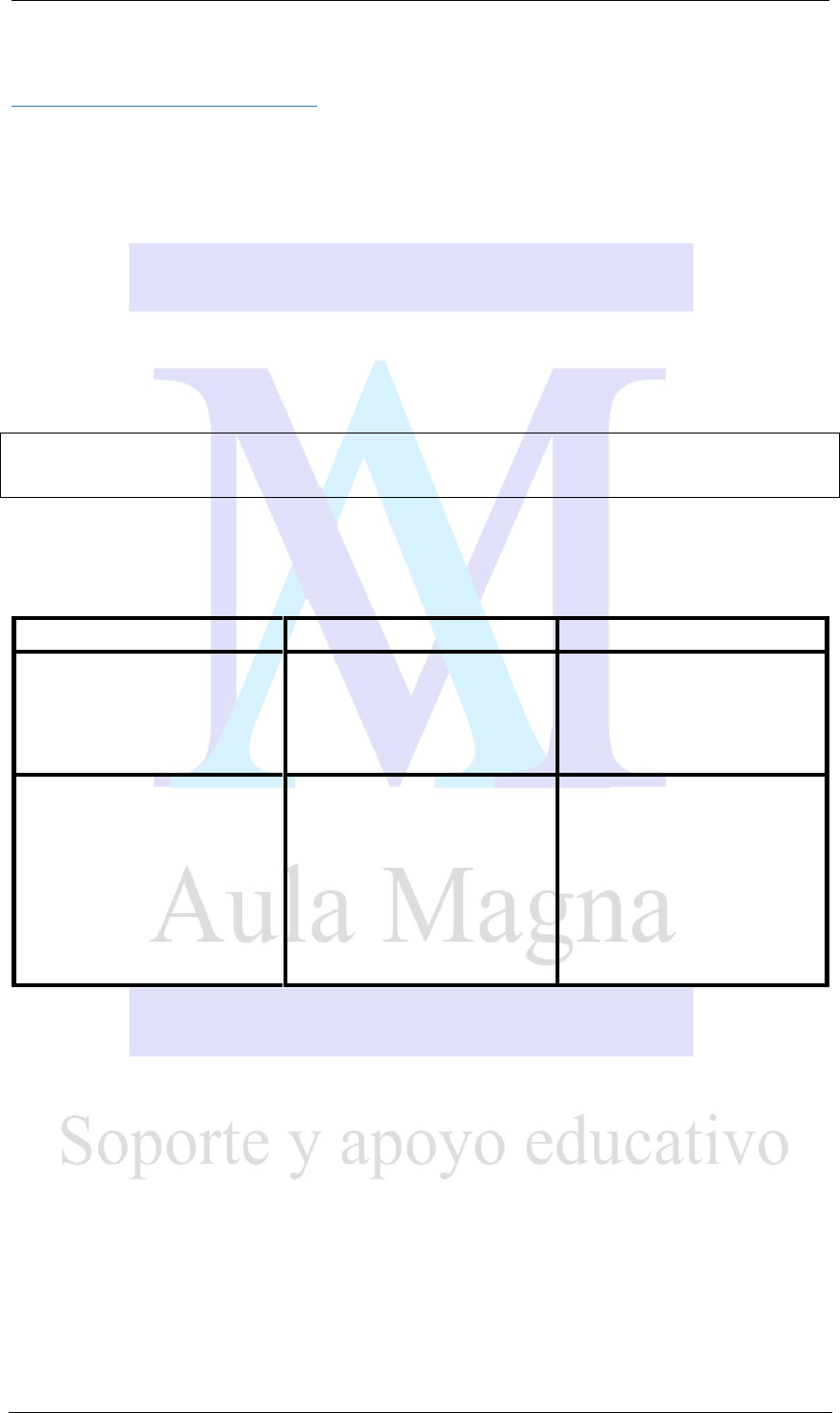
Estado
Forma
Volumen
Partículas
Compresibilidad
Sólido
Definida
Definido
Unidas
rígidamente; muy
empacadas
Muy pequeña
Líquido
Indefinida
Definido
Móviles, unidas
Pequeña
Gaseoso
Indefinida
Indefinido
Independientes y
relativamente
lejanas entre sí
Alta
Ejemplos de Estado de la Materia
Oxigeno
Vapor de agua
Cera de vela
Alcohol
Gas
Gas
Sólido
Líquido
AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
5
PROPIEDADES DE LA MATERIA
Casi siempre que miramos a nuestro alrededor, podemos distinguir las distintas clases
de
materia que forman los cuerpos que nos rodean. Así distinguimos la
madera
, el
plástico
y la
pintura
de la silla que usamos para sentarnos, el
vidrio
y el
aluminio
de la
ventana, etc. Sabemos que todas esas
sustancias son materia y que cada una de ellas es
distinta a las demás. Si todas son
materia, han de tener algo en común, alguna propiedad
que nos permite afirmar que todas ellas son
materia. Por otro lado, como podemos
distinguir una
sustancia de otra, también debe haber algo que nos permite
diferenciarlas. Ese
algo que nos permite identificar y distinguir las cosas recibe el
nombre de
propiedad.
Propiedad es una característica o atributo de un objeto o una sustancia que nos permite
clasificarla como igual o distinta a otra.
Si tomamos como criterio su dependencia de la cantidad de materia o masa, podemos
clasificarlas en:
PROPIEDADES
DEFINICION
EJEMPLOS
EXTENSIVAS
Son aquellas que
dependen de la cantidad
de materia considerada.
Masa, volumen, peso,
superficie, cantidad de
calor absorbido o cedido,
etc.
INTENSIVAS
Son aquellas que no
dependen de la cantidad
de materia considerada.
Las propiedades
organolépticas también
están dentro de esta
categoría.
Densidad, dureza,
elasticidad, peso
específico, elasticidad,
temperatura, punto de
ebullición, punto de
fusión, índice de
refracción, etc.
Ejercitemos…
1.-Para una porción de mercurio (Hg) se determinaron las siguientes propiedades.
Señale cuales son extensivas y cuales intensivas.
a) Color plateado brillante
b) volumen de 10 cc.
c) Masa: 136 gr.
d) Densidad: 13,6 g/ml
e) Insoluble en agua

AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
6
2.- Entre las propiedades que se enumeran coloque I si es intensiva o E si es extensiva.
a) Peso b) Volumen c) Peso específico
d) Punto de fusión e) Sabor g) Superficie
h) Temperatura i) Forma cristalina j) Masa
k) Punto de ebullición l) Olor m) Color
n) Dureza
Tomando como criterio el cambio o transformación en la composición de la materia, las
propiedades intensivas, a su vez se clasifican en:
PROPIEDAD INTENSIVA
DEFINICION
EJEMPLOS
FISICAS
Son aquellas que pueden ser
medidas u observadas sin que se
modifique la identidad y
composición de la sustancia
analizada.
Dureza, brillo,
elasticidad, densidad,
punto de ebullición,
punto de fusión, etc.
QUIMICAS
Solamente pueden ser observadas
a través de cambios o
transformaciones que
experimenta la materia en su
composición, es decir a través de
reacciones químicas.
La capacidad de
reaccionar con
oxígeno, la tendencia
a corroerse, a
explotar, a
enmohecerse, etc.
Físicas
Brillo
Volatilidad
Sabor, dureza
Maleabilidad
Ductibilidad
Viscosidad
Conductibilidad
Químicas
Arde en el aire
Hace explosión
Reacc. con ciertos ácidos
Reacc. con ciertos metales
Es toxico

AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
7
Los cambios químicos durante los cuales ciertas sustancias se convierten en otras se
denominan
REACCIONES QUIMICAS.
Las reacciones químicas se representan mediante una ecuación química de la siguiente
manera:
REACTIVOS PRODUCTOS
Los reactivos son las sustancias iniciales y los productos son las sustancias formadas
luego de ocurrida la reacción.
En las reacciones químicas la transformación de determinadas sustancias en otras, va
acompañada de variaciones de energías.
Cuando las reacciones liberan energía se denominan EXERGÓNICAS; en cambio las que
absorben energía se denominan ENDERGÓNICAS. Estas variaciones se manifiestan con
flujos de calor entre el sistema reaccionante y su entorno, así las exergónicas serán
EXOTÉRMICAS y las endergónicas serán ENDOTÉRMICAS.
TRANSFORMACIONES DE LA MATERIA
Una transformación es el cambio de las propiedades intensivas de un sistema material
en forma perceptible y permanente debido a la variación de algunas de las condiciones
tales como la presión, la temperatura y otras.
Fenómeno: transformación de la materia que puede ser percibido con nuestros sentidos.
Lluvia, tornado, puesta del sol.
TRANSFORMACIONES FÍSICAS: Son modificaciones que se presentan sin un cambio en
la composición de una sustancia. NO se forman nuevas sustancias.
1. Se las puede repetir tantas veces como se quiera con la misma proporción
2. Antes y después de la transformación, la sustancia no ha cambiado
3. Sólo se modifica alguna de las propiedades intensivas
4. Persiste mientras dure la causa que la provoque

AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
8
5. Se acompañan de un gasto de energía
En general, las propiedades físicas se alteran
considerablemente cuando la materia
experimenta cambios físicos.
Ejemplos
•
Los cambios de estado de la materia
•
Cortar carne en bifes
•
Romper un vidrio
•
Cortar una hoja
¡¡¡CUIDADO!!! No confundir propiedad con transformación
• Una propiedad distingue a una sustancia de otra, pero un cambio es una conversión de
una forma a otra.
•
El punto de fusión de una sustancia propiedad física
•
Proceso de fusión (el paso de un sólido a líquido) cambio físico
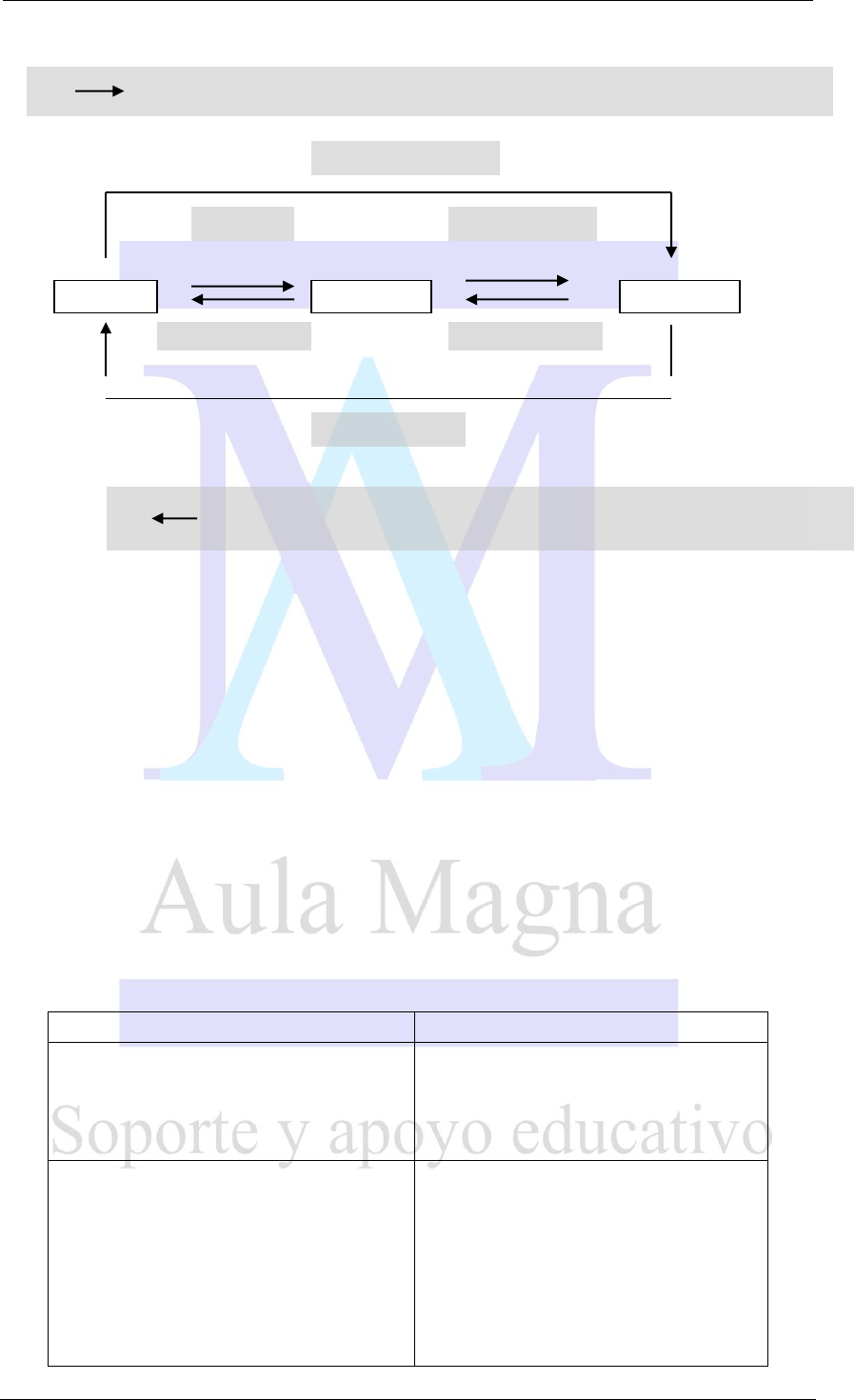
LOS CAMBIOS DE ESTADO: ejemplos de transformaciones físicas
¿Qué determina que la materia presente uno u otro estado?
Las dos variables que determinan el estado de la materia son la
temperatura y la presión.
De este modo la materia puede pasar de un estado a otro, mediante procedimientos
físicos que hagan variar la temperatura o presión o bien ambas a la vez. Todos los
cambios de estados ocurren a temperatura constante.
AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
9
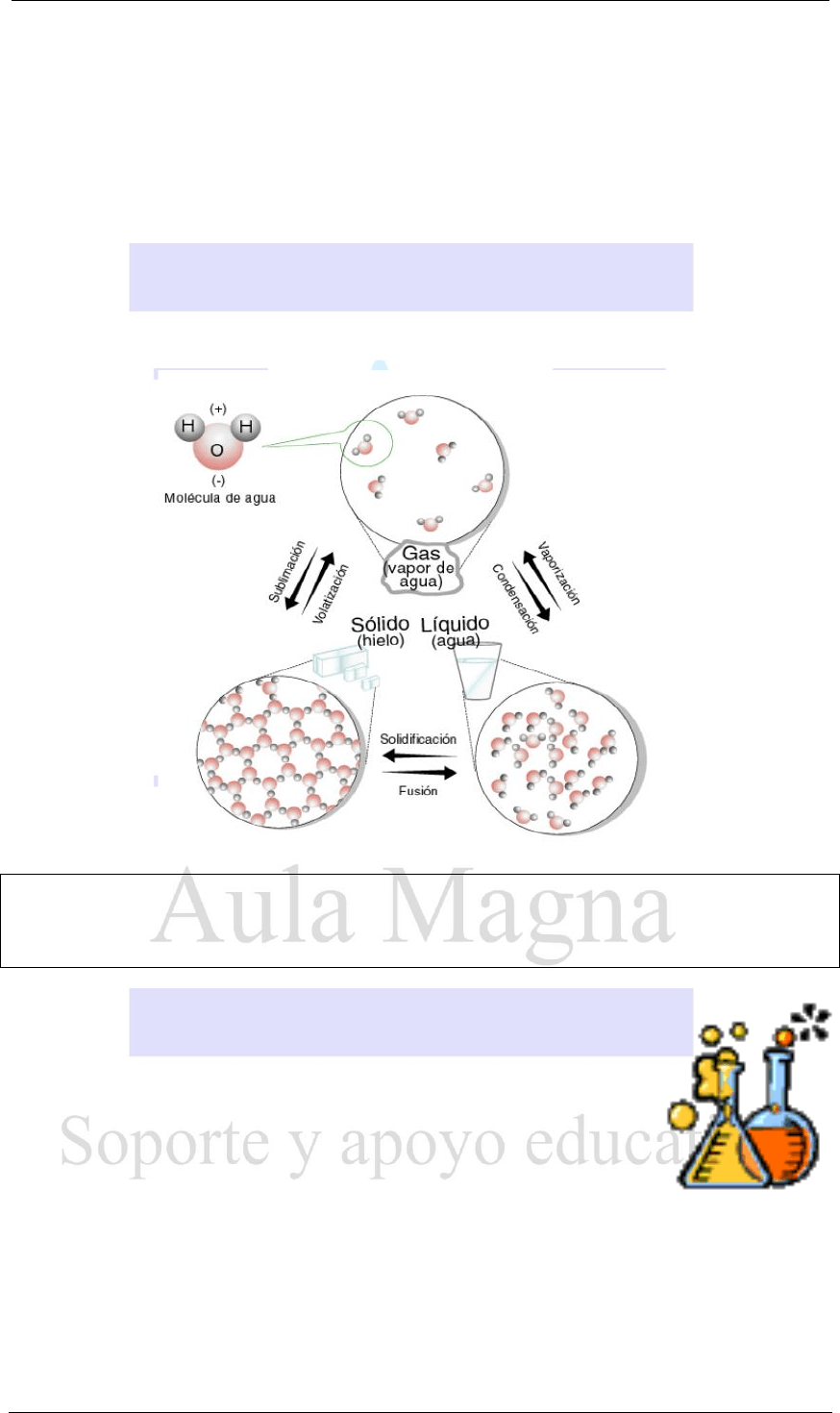
1. Fusión: es el pasaje del estado sólido al líquido producido por la absorción de energía.
Ocurre cuando el sólido alcanza el “Punto de Fusión”, que es la temperatura en la que
funde un sólido (Ej.: cuando se derrite el hielo)
2. Solidificación: es el pasaje del estado líquido al sólido producido por un pérdida de
energía (Ej.: cuando se congela el agua)
Nota: la temperatura a la que solidifican los líquidos es igual a la temperatura de fusión,
ya que se trata de procesos inversos.
3. Vaporización: es el pasaje de estado líquido al gaseoso producido por aumento de la
temperatura.
Dentro de este proceso hay que distinguir otros dos:
EVAPORACIÒN
EBULLICIÒN
Es el pasaje únicamente de las
moléculas de la
“superficie del
líquido” al estado gaseoso.
Comprende a toda la masa de
líquido.
Sucede en un rango amplio de
temperaturas.
Este proceso ocurre cuando se
alcanza el
“Punto de ebullición”: la
temperatura a la cual todas las
moléculas del líquido están en
condiciones de pasar al estado
gaseoso.
LIQUIDO
SÓLIDO
GASEOSO
SUBLIMACION
VOLATILIZACION
VAPORIZACION
FUSION
SOLIDIFICACION
CONDENSACION
Aumento de la temperatura (endotérmico) y/o Disminución de la presión
Disminución de la temperatura (exotérmico) y/o Aumento de la presión
AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
10
4. El pasaje del estado gaseoso al líquido puede ocurrir por dos procesos:
a)
Licuefacción o licuación: cuando es producido por aumento de la presión (Ej.: cuando
llueve).
b) Condensación: cuando es producido por un descenso de la temperatura.
5. Sublimación: es el pasaje del estado sólido al gaseoso sin pasar por el líquido.
Abarca tanto este proceso como el inverso. A veces suele subdividirse en dos partes:
a) volatilización: es el pasaje del estado sólido a gaseoso.
b)
cristalización o deposición: es el pasaje del estado gaseoso al sólido.
TRANSFORMACIONES QUÍMICAS: Son modificaciones que se pueden observar solo
cuando se presenta un cambio en la composición de una sustancia. Se forman nuevas
sustancias.
1. Sobre la misma proporción no puede repetir la misma
transformación
2. Después de la transformación, la sustancia ha cambiado, se ha
transformado en una u otras sustancias (se forman una o más
sustancias nuevas)
3. Las propiedades intensivas de las nuevas sustancias son distintas
de la original
4. Se acompañan de un mayor gasto de energía (se libera o se absorbe energía)

AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
11
También conocidas como
Reacciones químicas:
Estado inicial = reactivos, estado final =productos.
Las propiedades de las nuevas sustancias son diferentes de las
sustancias anteriores.
En un cambio químico
- puede producirse un gas,
- puede haber desprendimiento de calor,
- puede ocurrir un cambio de color o
- puede aparecer una sustancia insoluble.
Ejemplo:
• Cl
2
+ 2 Na 2 NaCl
•
La digestión de los alimentos
•
La oxidación celular (respiración celular) de la glucosa
•
La combustión de papel (arde)
•
La descomposición del agua por acción de la electricidad (electrólisis) en sus
elementos constituyentes
Ejercitemos…
De la siguiente lista, clasifique los fenómenos que representan cambios físicos o
químicos:
a) Teñido
b) de telas.
c) Evaporación del agua
d) Cambio de posición de un objeto
e) Cocción de alimentos
f) Carbón que arde
g) Fusión del hielo
h) Fermentación del jugo de uva
i) Oxidación del hierro
j) Combustión del gas butano
k) Ruptura de varilla de vidrio.
SISTEMAS MATERIALES
Un sistema material es una porción limitada de materia que separamos para poder
estudiarla mejor. En él se reúnen características observables.
Un trozo de mármol, una botella que contiene agua líquida, constituyen sistemas
materiales.

AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
12
CLASIFICACIÓN DE LOS SISTEMAS MATERIALES
CRITERIO 1: COMPORTAMIENTO DEL SISTEMA MATERIAL RESPECTO A SU ENTORNO
SISTEMA MATERIAL ABIERTO: aquellos donde hay
transferencia de masa y energía entre el sistema y el medio. Ejemplo:
agua hirviendo en un jarro sin tapa.
SISTEMA MATERIAL CERRADO: aquellos donde sólo hay transferencia
energía entre el sistema y el medio. Ejemplo: agua hirviendo en un
jarro herméticamente tapado.
SISTEMA MATERIAL AISLADO: aquellos donde no hay
transferencia de masa ni de energía entre el sistema y el medio.
Ejemplo: vaso térmico utilizado para conservar líquidos a
temperatura constante (termo o vaso de Dewar)

AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
13
CRITERIO 2: MACROSCÓPICO o SIMPLE VISTA
SISTEMA MATERIAL HOMOGÉNEO: aquellos que están
formados por una sola parte o fase. Ejemplo: agua potable
contenida en un vaso, una moneda, aire dentro de una botella.
Una
fase tiene propiedades intensivas en todos sus puntos.
SISTEMA MATERIAL HETEROGÉNEO: aquellos que están
formados por más de una parte o fase. Ejemplo: agua con varios
cubos de hielos, sal de cocina y arena finamente dividida, un trozo
de granito.
En un sistema heterogéneo cada fase conserva sus
propiedades características, ya sea que se encuentre como unidad
o subdividida.
Si estudiamos cualquier sistema heterogéneo encontraremos que tomando aisladamente
cada uno de sus constituyentes, éstos son homogéneos. A estos sistemas homogéneos
que integran un sistema heterogéneo, se los llama
fases.
Como las fases se hallan separadas entre sí por superficies observables diremos que:

AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
14
Fase es cualquier parte homogénea y físicamente distinta, separada de las otras partes
de un sistema por superficies límites definidas.
Así decimos que el sistema heterogéneo agua-aceite que pusimos como ejemplo es un
sistema
bifásico
(dos fases). El granito es un sistema trifásico
(tres fases)
Por ejemplo: un trozo de hielo, un grano de sal puro, etc.
Componente es aquello de lo cual está formada una fase.
En todo sistema son importantes, además de las fases, el
número de constituyentes.
Los
constituyentes son las sustancias que forman el sistema.
Podemos enunciar, más concretamente, que:
El número de constituyentes es el menor número de sustancias que lo integran por
medio de las cuales se puede expresar la composición de cada fase existente.
Sistema Material Heterogéneo
•
Fases: 3 (bebida, hielo, rodaja de naranja)
•
Componentes: 3 (agua, naranja, bebida)
Sistema Material Homogéneo
•
Fases: 1 (líquido)
•
Componentes: 1 (agua)

AULA MAGNA QUIMICA INGRESO MEDICINA
RICHARDSON 40-PB NUEVA CORDOBA 0351 – 4683185
Página
15
Ejercitemos…
Señale en los siguientes sistemas materiales si es homogéneo o heterogéneo:
a) Agua i) Humo de cigarrillo
b) Agua y aceite j) Agua y arena
) Agua y aceite k) Sal común
c) Azufre en agua l) Almidón en agua
d) Nafta en agua m) Agua con sal disuelta
e) Aceite y vinagre n) Humo
f) Clara de huevo ñ) Hielo con aire
g) Tinta china
h) Agua con hielo
CRITERIO 3: COMPOSICIÓN DEL SISTEMA MATERIAL
SUSTANCIA PURA: una sustancia es pura cuando no contiene ninguna otra
sustancia mezclada con ella (criterio de pureza). Tiene una composición definida y fija.
SISTEMA
MATERIAL
HOMOGENEO
SUSTANCIA
PURA
SIMPLE
COMPUESTA
SOLUCION
HETEROGENEO
DISPERSIONES
GROSERAS
DISPERSIONES
FINAS
SUSPENCIONES
EMULSIONES
DISPERSIONES
COLOIDALES
Este documento contiene más páginas...
Descargar Completo
APUNTE DE QUIMICA AULA MAGNA- MEDICINA 2018 (1).pdf
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Descargar
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
