
GUIA DE ESTUDIO:
Acido úrico (revisión bibliográfica)
Cátedra de Bioquímica – Facultad de Medicina – USAL
2020
1

Ácido úrico (AU)
En los humanos el ácido úrico es el producto final de la degradación de las purinas (VER GUÍA DE
PURINAS Y PIRIMIDINAS) ya sea exógenas (proveniente de la dieta) y endógenas (ya que a
diferencia de otros mamíferos no tiene la enzima uricasa que lo transforma en alantoína); la síntesis del
ácido úrico es catalizada por la xantino oxidasa y/o su isoforma la xantino deshidrogenasa.
La producción endógena proviene fundamentalmente del hígado, intestino y otros tejidos como el
músculo esquelético y cardíaco, riñón y endotelio vascular (Journal of Advanced Research 2017; 8:
487-493).
En un adulto normal se producen en promedio 700 mg por día de ácido úrico, aproximadamente
dos tercios del recambio de urato se excreta por la orina y un tercio por la materia fecal (en el
colon es degradado por las bacterias en un proceso llamado uricolisis intestinal por el cual es
transformado en alantoína por la enzima uricasa).
2

Los varones tienen un valor normal de uricemia de 3.4-7.0 mg/dl y las mujeres de 2.4-5.7 mg/dl,
diferencia que desaparece después de los 40-50 años de edad, lo cual se relaciona a diferencias
hormonales entre ambos sexos (los estrógenos inhiben la reabsorción de uratos a nivel tubular a
nivel del transportador de aniones orgánicos); se define hiperuricemia con valores mayores a 7.0
mg/dl en el hombre y a 6.0 mg/dl en la mujer.
Los niveles séricos están ligados a una serie de variables, como la raza como por ejemplo los
afroamericanos tienen niveles que duplican a la de los caucásicos, también como hemos mencionado
está ligado al género, a la dieta (alimentos ricos en purinas y en AU, fructosa, alcohol), y a ciertos
fenotipos como la obesidad y el síndrome metabólico, al ritmo circadiano donde los niveles de ácido
úrico matutinos son más altos que en el resto del día, también depende del grado de la hidratación, la
actividad física (el ejercicio moderado reduce los niveles de ácido úrico mientras que el intenso lo
incrementa), el consumo de algunos fármacos (las tiazidas incrementan la concentración de AU al
aumentar la reabsorción en el túbulo proximal; la ciclosporina, pirazinamida, ácido nicotínico y dosis
bajas de aspirina interfieren con la excreción renal incrementando la concentración de AU), la edad ya
que sus valores aumentan con la misma (la uricemia de los niños es de 3-4 mg/dl) , la excreción renal
y la genética.
MUY IMPORTANTE: Contenido en purinas de algunos alimentos (mg purinas/100g de alimento)
Cantidad insignificante
de purinas
(0- 50mg)
pero pueden contener
AU
Cantidad mediana de
purinas
(50-100mg) y
contienen AU
Cantidad alta de
purinas
(100-200mg) y
contienen AU
Cantidad muy alta de
purinas
(más de 200mg) y
contienen AU
Huevos, frutos secos,
quesos, arroz, cebolla,
remolacha, tomate,
naranja, palta, banana,
calabaza, zanahoria,
durazno, lechuga, uva,
ananás, papa, pastas,
maíz, espárragos,
ciruela, frutilla, leche y
derivados, harinas,
coliflor (contiene 50mg
de AU), espárragos
cocidos (contienen
25mg de AU), puerro
(contiene 80 mg de AU)
Ostras (contiene 87 mg
de AU), hongos
(contienen 54mg de
AU), espinaca
(contienen 80mg de
AU), chauchas
(contienen 50 mg de
AU)
Pollo, carne de vaca,
carne de cerdo,
pescados de río, pato,
crustáceos, salmón,
garbanzos, lenguado,
lentejas, bacalao,
habas, mariscos,
embutidos
Sesos, atún en aceite,
riñón, hígado,
mejillones, almejas,
sardinas en aceite,
extracto de carne,
caldo de carne,
mollejas
3

El consumo de fructosa estimula la producción de AU, ya que durante el metabolismo de la misma,
la fructosa es fosforilada a fructosa-1 fosfato (F1P), reacción catalizada por la fructoquinasa en el
hígado, esta reacción es rápida y no tiene feedback negativo, decreciendo por lo tanto los niveles de
ATP. Posteriormente la aldolasa B desdobla a la F1P en dihidroxiacetona fosfato (DHAP) y
D-gliceraldehido, esta reacción es lenta y por lo tanto cuando ingerimos mucha fructosa, la F1P se
acumula y el fosfato intracelular decrece, lo cual estimula la AMP deaminasa (AMPD), que cataliza la
degradación de AMP a inosina monofosfato, incrementando la degradación de las purinas, produciendo
AU, el cual genera estrés oxidativo mitocondrial, inhibe a la aconitasa del ciclo de Krebs con la
acumulación de citrato , lo que estimula a la citrato liasa y proveyendo acetil CoA para la síntesis de
ácidos grasos, lo que genera lipogénesis hepática e hígado graso; además el consumo crónico de alta
concentraciones de fructosa suprime la excreción renal de AU.
El ácido úrico posee un pKa de alrededor de 5.75, lo que indica que al pH de la sangre (7.4) este ácido
libera su protón del grupo OH del C8 y se convierte en la forma iónica urato monosódico; a 5.75 la
forma iónica se equilibra con la no ionizada, mientras que a pH menor predomina la forma no disociada.
Al pH de la sangre el 98% está como urato monosódico.
Esto tiene importancia, ya que el ácido úrico es menos soluble en agua que el urato, por lo que una
orina acidificada aumenta la cantidad de ácido úrico y este tiende a precipitar; en cambio, si la
orina se alcaliniza se produce un aumento de urato, con mayor posibilidad de excreción en el medio
acuoso de la orina.
El AU tiene una baja solubilidad en agua y su límite de solubilidad es de 6.8 mg/dl, superado este
valor el AU puede cristalizar originando gota o nefrolitiasis.
4

El ácido úrico es un antioxidante (Atherosclerosis 2014; 237: 562-567) contra anión superóxido,
radical hidroxilo y oxígeno singulete, al bloquear al anión superóxido evita su reacción con NO para
formar peroxinitrito el cual tiene un impacto en enfermedades neurodegenerativas, por lo tanto el ácido
úrico podría actuar como neuroprotector, también puede reaccionar con peroxinitrito y prevenir su
acción sobre las proteínas (nitrosilación), la peroxidación lipídica y la inactivación de la
tetrahidrobiopterina (BH4) (ver figura función A), protege a la oxidación de la LDL mediada por el Cu++
(ver figura función B) , y si bien es un potente antioxidante en el medio extracelular hidrofílico
(representa aproximadamente el 50-75% de la capacidad antioxidante del plasma humano) debido a las
propiedades de hidrosolubilidad y a la existencia de otras moléculas antioxidantes capaces de reciclar
al AU para continuar su acción, como es el caso de la vitamina C; tiene además un efecto prooxidante
en el medio intracelular o en zonas altamente hidrofóbicas como la placa aterosclerótica o el
tejido adiposo, mediado por la NADPH oxidasa; en las CMLV activa a la MAPK y a NFkB, lo que
estimula la formación de mediadores inflamatorios (ver figura función C).
La explicación para estas alteraciones es que los niveles de ácido úrico se relacionan con la actividad
de la xantina oxidoreductasa (XOR), esta enzima es un miembro de la familia de las enzimas que
contienen Mo y FAD, es un homodímero que contiene dos subunidades iguales, cada una
conteniendo 2 centros (2Fe-2S), y que posee dos formas la xantina deshidrogenasa (XDH) y la
xantino oxidasa (XO) (Med Sci Monit 2016; 22: 2501-2512).
5

Difieren estas dos formas en que la XO sólo reduce oxígeno a peróxido de hidrógeno y anión
superóxido), mientras que la XDH puede reducir tanto el oxígeno como el NAD, pero con su mayor
afinidad por este último (Atherosclerosis 2014; 237: 562-567).
La XO es la forma predominante en endotelio vascular inflamado y en tejidos isquémicos, la XDH puede
ser convertida en XO por la oxidación de residuos sulfidrilos o por proteólisis.
Ambas formas catalizan la conversión de la hipoxantina a xantina, y de xantina a ácido úrico, además la
XOR también genera ROS (European Journal oh Heart Failure 2009; 11: 444-452), la XOR ligada al
endotelio se incrementa en más de 200% en vasos dañados, y muestra una relación negativa con la
vasodilatación mediada por el endotelio (Circulation 2002; 106: 3073-3078), ya que los ROS inhiben a la
NO sintasa.
La XOR está constitutivamente expresada en su forma deshidrogenasa fundamentalmente en
células epiteliales, hígado e intestino. El nivel sérico es muy bajo en condiciones normales, sin embargo
puede aumentar en condiciones patológicas, en las cuales la XOR se libera de tejidos dañados y es
convertida a su forma oxidasa, que puede unirse a células endoteliales donde es responsable de
generar disfunción endotelial (Atherosclerosis 2014; 237: 562-567).
(Med Sci Monit 2016; 22: 2501-2512)
La habilidad de la XO para generar ROS es un estimulo importante para la expresión de moléculas de
adhesión en los leucocitos , su activación , y su adherencia a la células endoteliales dañadas , la
activación de la XO a través de la liberación de ROS , activa metaloproteinasas, las cuales están
implicadas la ruptura de las placas arteriosclerótica .
6

La hipoxia, los lipopolisacáridos, el interferón gama, la IL-1, la IL-6, el TNF-α, el cortisol y la prolactina
han sido identificados como reguladores positivos de la expresión de XOR (Hypertension 2003; 41:
1287-1293).
A título informativo: la Adenosina es sintetizada y liberada por miocitos vasculares y cardíacos, su unión
a receptores específicos causa relajación del músculo liso vascular y vasodilatación arteriolar, bajo
condiciones de hipoxia e isquemia tisular, la síntesis y la liberación de Adenosina se incrementa (J
Mo Cell Cardiol 1994; 26: 1069-1080), la cual es degradada a ácido úrico por el endotelio, el cual en
condiciones de isquemia aumenta al igual que la actividad de la XO.
La isquemia genera un aumento en el ácido láctico, el cual compite a nivel tubular proximal con
el ácido úrico por intercambiador de aniones orgánicos.
Mecanismo renal de reabsorción de urato:
La excreción renal de ácido úrico está relacionada con varios componentes: filtración glomerular,
reabsorción (99%) en el túbulo contorneado proximal (TCP), la resecreción (50%) y reabsorción post
secreción (80%), con lo cual aproximadamente sólo el 10% del AU filtrado aparece en la orina.
La mayoría de las hiperuricemias se deben a ineficiente excreción renal, la cual es regulada por
varios transportadores.
En el riñón el urato filtrado es reabsorbido en su mayoría en el túbulo proximal, proceso que depende de
la existencia de transportadores en el túbulo proximal: un intercambiador urato/anión (URAT1), crítico en
la regulación de los valores de ácido úrico, es el mayor transportador de reabsorción de urato,
ubicado en la membrana apical de las células del túbulo contorneado proximal en intercambio con
aniones que son transportados hacia la luz tubular para mantener un balance eléctrico adecuado, su
inactivación conduce a hipouricemia. Hay drogas que pueden inhibir a URAT1, para inhibir la
reabsorción, lo cual puede explicar su efecto uricosúrico (probenecid, sulfinpirazona, losartán,
brenzbomarona, fenofibrato).
Otro transportador para la reabsorción de urato es el sGLUT9, también interviene el transportador
ABCG2 de la membrana apical que media la secreción de urato y cuya disfunción es una causa
común de hiperuricemia.
MRP4 es un transportador presente en la membrana apical de los túbulos proximales y controla la
eliminación de urato.
7

La salida del AU hacia el espacio peritubular se realiza mediante los transportadores basolaterales, el
LGLUT9.
Tras la primera fase de reabsorción, se produce un fenómeno de secreción tubular activa por el
transportador de sodio-fosfato (NPT1) y es inhibida por diversos fármacos como los diuréticos, los
salicilatos a dosis bajas y la ciclosporina A, también puede verse limitada en los pacientes con
enfermedades renales que cursen con alteraciones de las funciones tubulares, esta capacidad de
secreción está determinada genéticamente y es una causa frecuente de hiperuricemia.
La excreción por el riñón de una variedad de fármacos y metabolitos que son aniones orgánicos
dicarboxílicos es mediada, mediante un intercambio con el urato, por una familia de transportadores
multiespecíficos de aniones orgánicos OAT, como el OAT4 y OAT10 que se localizan en la membrana
apical e intervienen en la reabsorción de urato y el OAT1 y OAT3 que se localizan en la membrana
basolateral de los túbulos proximales que funcionan como intercambiadores de urato/aniones.
La reabsorción en el túbulo proximal de AU compite con ácidos orgánicos, como el oxálico, láctico,
cuerpos cetónicos, por lo que situaciones metabólicas donde haya gran producción de estos ácidos
estará acompañada de una hipoexcreción de AU.
Transportadores de
reabsorción de urato
Transportadores de excreción
de urato
URAT 1
OAT1 (recaptación)
OAT4/OAT10
OAT3 (recaptación)
SGLUT9
MRP4 (excreción)
LGLUT9
ABCG2 (excreción)
NTP1 (excreción)
Causas de hiperuricemia:
Hiperuricemia primaria:
Con hiperproducción de ácido úrico:
● Idiopática, deficiencia de aldolasa, déficit de Hipoxantina-guanina-fosforribosil transferasa
(déficit completo en el síndrome de Lesch-Nyhan), hiperactividad de la fosforribosil-pirofosfato
sintetasa, glucogenosis I, III, V, VII (debido al aumento de síntesis de PRPP desde glucosa 6P
además de la acidosis láctica y cetosis que aparece en estos pacientes).
8

Con hipo excreción de ácido úrico: defecto en la secreción tubular de urato.
Hiperuricemia secundaria:
Con hiperproducción de ácido úrico:
● Origen exógeno: dieta hipercalórica y la obesidad asociada e ella, dietas hipocalóricas extremas,
dieta rica en purinas, ingesta excesiva de fructosa, ingesta excesiva de alcohol (aumento en la
producción endógena de purinas y disminución en la excreción renal de úrico).
● Asociado a enfermedades que cursan con aumento del recambio celular: enfermedades linfo y
mieloproliferativas crónicas, síndrome de lisis tumoral
Con hipo excreción de ácido úrico:
● Secundaria a fármacos: diuréticos (tiazidas, furosemida), ciclosporina A, salicilatos o
fenilbutazona (en dosis bajas), tuberculostáticos (pirazinamida, etambutol), antirretrovirales
● Secundaria a enfermedad renal: IRC, IRA, hipertensión arterial, contracción crónica de volumen
● Misceláneas: acidosis láctica, cetosis, hipertiroidismo
Resumen de las principales causas de hiperuricemia (Med Sci Monit 2016; 22: 2501-2512):
La hiperuricemia y la gota se asocian con otras enfermedades, como litiasis renal, hipertensión,
enfermedad renal crónica, diabetes mellitus, hiperlipidemia, obesidad, síndrome metabólico y aumento
del riesgo de enfermedad cardiovascular.
Comorbilidad en la hiperuricemia y gota
%
Obesidad
53
Hipertensión
74
Diabetes mellitus
25
Hipercolesterolemia
72
Hipertrigliceridemia
40
9
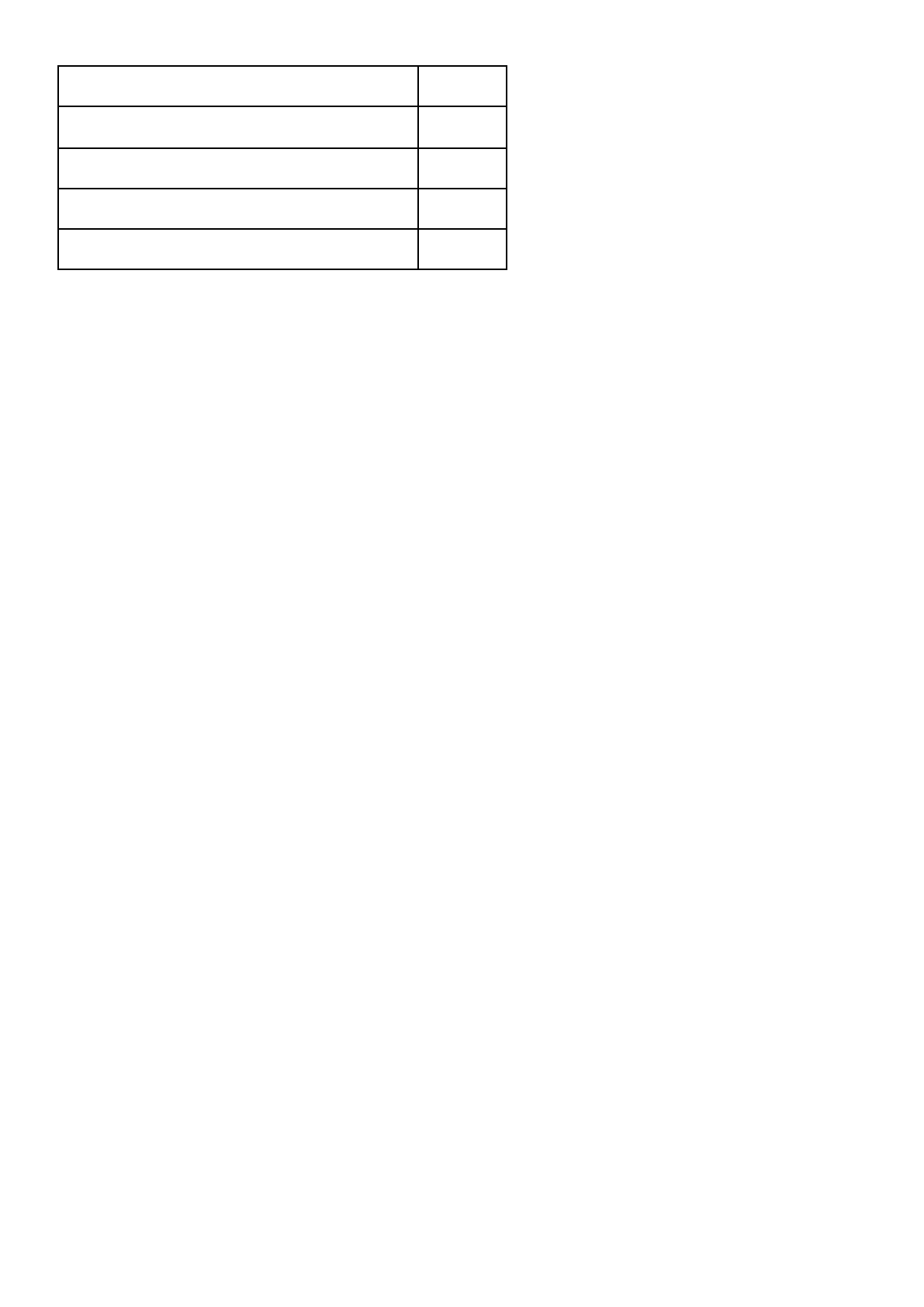
Síndrome metabólico
61
Cardiopatía isquémica
10
Accidente cerebrovascular
10
Enfermedad renal crónica estadio 2
71
Litiasis renal
24
Gota:
La hiperuricemia es una afección caracterizada por niveles anormalmente elevados de urato sérico
(UAs), mientras que la gota, la forma más común de artritis inflamatoria, surge de la posterior deposición
de cristales de urato cuando las concentraciones se saturan.
La gota se ha definido como "una enfermedad metabólica progresiva caracterizada por hiperuricemia
sintomática y la deposición de cristales de urato monosódico (MSU) en articulaciones y tejidos blandos
debido a un desequilibrio en la absorción de ácido úrico, síntesis o excreción".
El signo clínico inicial de un ataque agudo de gota es el dolor incapacitante severo, que generalmente
implica una sola articulación, que normalmente se resuelve espontáneamente durante un período de
unos días a semanas sin intervención, aunque el tratamiento con medicamentos antiinflamatorios como
la colchicina, los AINE (medicamentos antiinflamatorios no esteroideos) y los corticoides generalmente
mejorarán los síntomas más rápidamente. Tras la resolución de un ataque agudo, el paciente entrará en
un intervalo sin síntomas.
Si los valores de UAs siguen siendo altos, los depósitos de cristal MSU pueden crecer y expandirse a
otros sitios, lo que conduce a una mayor inflamación y lesiones de tejido/articulación asociadas.
A menudo se afirma que la prevalencia de hiperuricemia y gota ha aumentado en los últimos años,
aunque hay relativamente pocos estudios longitudinales en poblaciones geográficamente diversas y el
aumento de las tasas de diagnóstico puede desempeñar un papel importante. Se ha destacado que la
distribución de la gota varía significativamente en todo el mundo, lo que puede reflejar factores como la
etnia, la dieta y los factores socioeconómicos.
La incidencia de la gota se incrementa con la edad y el grado de hiperuricemia, por ejemplo se presenta
sólo el 0.1% de los pacientes con AU menor a 7.0 mg/dl, en 0.5% de los que tienen de 7.0-8.9 mg/dl y
en el 4.9% de los que tienen AU mayor a 9.0 mg/dl.
El episodio inicial usualmente aparece entre la cuarta y sexta década de vida.
La afectación articular tiene como manifestación típica la artritis gotosa, que en su forma crónica
puede provocar una gran destrucción articular.
Cuando se produce un acúmulo progresivo de urato en articulaciones, hueso, tejidos blandos y cartílago
se llaman tofos, que son acumulaciones de uratos rodeados de células mononucleares, que causan
deformidad y desestructuración de tejidos blandos y duros, las localizaciones más frecuentes son el
hélix, bolsas olecranianas, manos, muñecas, pies, rodillas, y tendón aquíleo.
10

También la hiperuricemia puede producir la nefropatía gotosa y la urolitiasis por ácido úrico.
La hiperuricemia es un trastorno metabólico muy frecuente con una prevalencia que oscila entre 2-13
% de la población adulta.
La patogénesis de la gota se caracteriza (microscopio óptico con luz polarizada) por la precipitación de
cristales de urato monosódico en las articulaciones, los cristales (tienen birrefringencia negativa)
son fagocitados por los neutrófilos y macrófagos y se produce la activación de un proceso inflamatorio y
la injuria tisular.
La artritis gotosa suele localizarse más frecuentemente (aproximadamente el 50% de los casos) en la
primera metatarso falángica (podagra), otras articulaciones afectadas con frecuencia son rodilla, tobillo,
tarso y muñeca, el 95% de los pacientes son hombres y en general en la quinta década, la
monoartritis es característica y las pruebas de laboratorio presentan aumentos de reactantes de fase
aguda y posible leucocitosis con desviación a la izquierda, hiperuricemia en más del 95% de los casos
de gota aguda y 100% si existe gota tofácea crónica no tratada. El diagnóstico de certeza se obtiene
con el estudio de líquido articular en el que aparecen cristales de urato monosódico intra y
extracelulares con forma de aguja y birrefringencia negativa al microscopio de luz polarizada.
Patogenia de la gota:
La elevación de los niveles de ácido úrico en plasma por encima de su punto de saturación a 37ºC en
un medio con pH 7.4 (7mg/dl) produce en sujetos predispuestos a nuclear cristales de urato, la
formación de cristales de monourato sódico en los tejidos, el punto de saturación se reduce con el
descenso del pH y de la temperatura.
Tres factores influyen principalmente en la génesis del depósito tisular de uratos: nivel de
hiperuricemia (la incidencia de gota es proporcional al grado de hiperuricemia), tiempo durante
el que persiste la misma y la predisposición.
Para que la hiperuricemia produzca manifestaciones clínicas, parece requerirse un tiempo suficiente, ya
que la formación de los cristales es lenta.
11
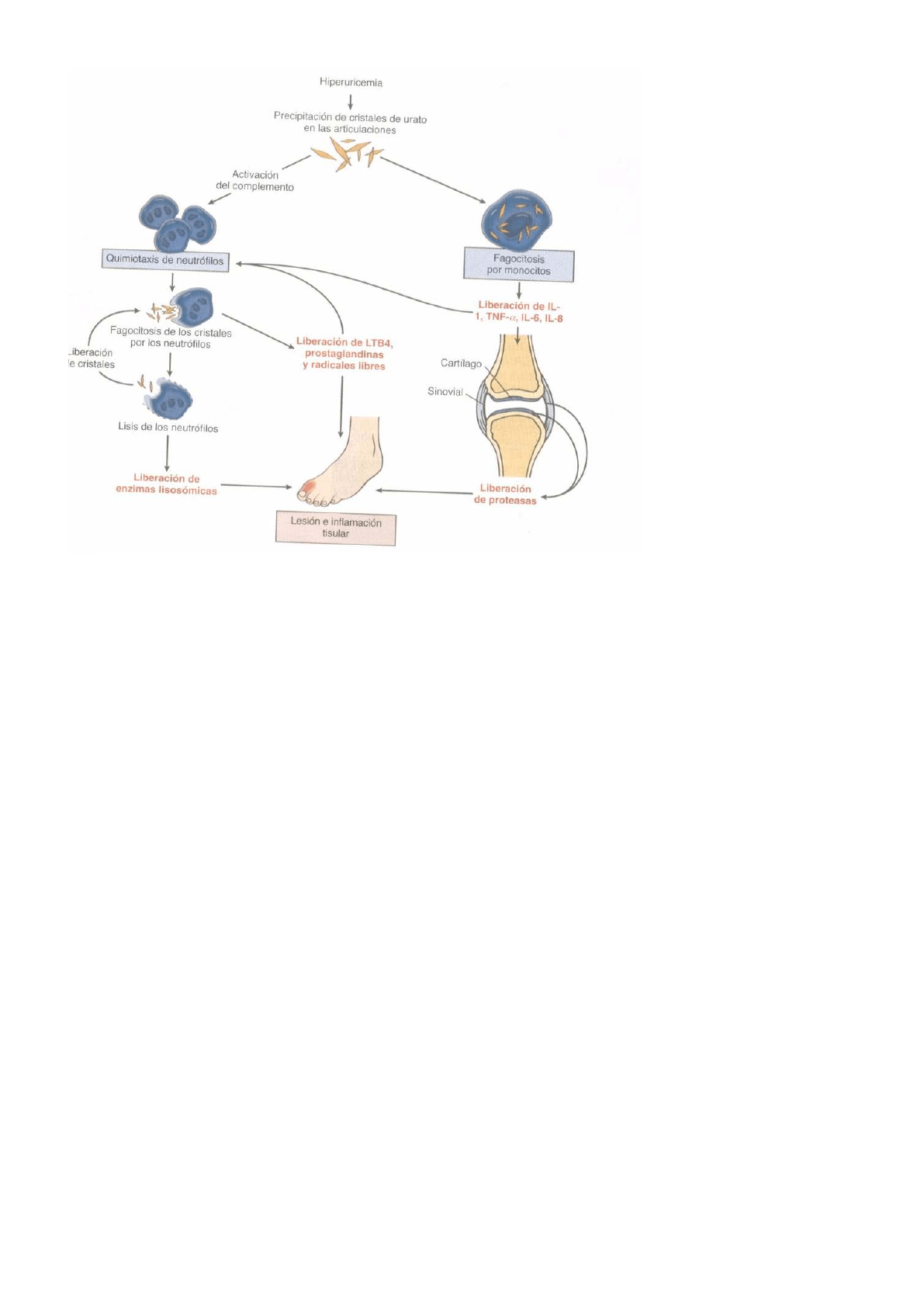
Los cristales de urato monosódico se depositan en los tejidos a nivel de las diversas estructuras
articulares, como el cartílago hialino y la membrana sinovial, también se pueden depositar en otros
tejidos, especialmente en el tejido celular subcutáneo, donde dan lugar a la formación de tofos, y
en el tejido renal en los individuos con hiperproducción de ácido úrico.
Por diversos motivos los cristales de urato se liberan del depósito tisular al líquido sinovial, estos
cristales libres pueden inducir una respuesta inflamatoria por diversos mecanismos. Primeramente los
cristales de urato favorecen la proteólisis y liberación de fragmentos proinflamatorios de
proteínas del sistema del complemento, capaces de producir quimiotaxis y activación celular, también
pueden estimular directa e indirectamente células residentes en la membrana sinovial, como los
monocitos, los sinoviocitos y las células cebadas.
Todo ello provoca la liberación de sustancias inflamatorias y quimiotácticas (C3a, C5a, LT, PG, NO,
IL, y otra quimoquinas), que conducen al inicio de los síntomas y los signos de inflamación articular.
Además, algunas de estas sustancias inducen la activación del endotelio vascular que, junto con los
factores quimiotácticos, favorece el reclutamiento de polimorfonucleares dentro de la articulación, los
cuales inician la fagocitosis de los cristales de uratos libres, fenómeno que se ve favorecido cuando los
cristales están recubiertos de proteínas como IgG, C3b, C1q o fibronectina, la fagocitosis induce, a su
vez, la liberación de factores quimiotácticos.
Por otra parte, los cristales de urato tienen la capacidad de producir la lisis de las membranas
celulares, citolisis y liberación de enzimas proteolíticas por parte de las células que fagocitan cristales,
en un círculo viciosos.
Los ataques de gota se presentan frecuentemente en varones de edad media (40-50 años), suelen
presentarse de forma brusca, apareciendo los síntomas y signos inflamatorios en 12 o 24 horas, pueden
acompañarse de síntomas generales como malestar general, febrícula o fiebre, los ataques agudos se
localizan frecuentemente en articulaciones, pero también se observan en bolsas periarticulares y
tendones.
Los primeros ataques suelen afectar a una sola articulación, siendo frecuente la afección de la primera
metatarsofalángica (podagra) en el 80% por ciento de los pacientes, tarsos, tobillos, rodillas (gonagra),
12

muñecas y dedos de manos (quiragra), los ataques de gota que afectan a varias articulaciones son más
frecuentes en pacientes con gota crónica, generalmente secundaria a tratamiento con diuréticos e
insuficiencia renal.
Entre 5 y 10 años después del inicio del los ataques de gota, muchos pacientes mostraran, en el caso
de no ser tratados con fármacos hipouricemiantes, depósitos subcutáneos de urato o tofos.
Algunos pacientes generalmente aquellos con uricemia elevada y ataques múltiples o incluso clínica
persistente, desarrollan lesiones permanente en las estructuras articulares y periarticulares, dando lugar
a la artropatía gotosa crónica.
En la práctica clínica, el estudio del manejo renal del acido úrico, permite la clasificación de los
pacientes en hipoexcreteros (aquellos que eliminan poco acido úrico con respecto a su uricemia) y
normoecretores (aquellos que eliminan una cantidad de acido úrico en la orina adecuada a su uricemia)
A título informativo: se han empleado diversos métodos para evaluar la excreción renal de acido úrico:
● Uricosuria: es la cantidad total de acido úrico excretada en orinas de 24 hs, en presencia de
hiperuricemia se define hipoexcreción como una excreción menor de 800mg/día de acido úrico
con dieta normal o menor a 600mg/día con un dieta de restricción de purinas.
● Aclaramiento de acido úrico: el aclaramiento es la capacidad de eliminar una sustancia de un
volumen determinado de plasma y se calcula como V minuto X U (orina) / U (en plasma), un
aclaramiento menor a 6 ml / minutos es indicativo de hipoexcreción renal.
● Excreción fraccionada de acido úrico: podría definirse como la cantidad porcentual excretada
con respecto a la cantidad filtrada en el glomérulo, para su cálculo usamos una muestra de orina
espontánea y empleamos la siguiente fórmula: (U o X C s)/U s X Co, se considera hipoexcretor
cuando el valor en adultos es menor al 5 %.
● Excreción de acido úrico por volumen de filtrado glomerular: se utiliza una orina espontanea
y el cálculo es el siguiente: U o X C s / C o, se considera como índice de hiperproducción cuando
el valor es mayor a 7.7 mg/dl y cifras menores a 0.5 mg/dl son indicativas de hiposecreción.
El control de factores que inducen hiperuricemia es el primer paso para el tratamiento de la
hiperuricemia, la reducción del sobrepeso y de la ingesta etílica, pueden ser maniobras terapéuticas
13

útiles para controlar la hiperuricemia, también se emplean fármacos como el allopurinol que es un
análogo de la hipoxantina, mientras que su principal metabolito, el oxipurinol es un análogo de la
xantina, y su mecanismo de acción es la inhibición competitiva de la xantino oxidasa, este tipo de
fármacos se usa en los pacientes que tienen hiperproducción de urato; en cambio en los pacientes que
tienen una depuración disminuida se usan fármacos uricosúricos como el probenecid, sulfinpirazona
que inhiben el transportador URAT1, aumentando la excreción de ácido úrico.
Los cálculos de ácido úrico (nefrolitiasis) representan del 5-10% de los cálculos urinarios, pueden
ser solamente de ácido úrico o una combinación de calcio y urato, la hiperuricosuria (mayor a 800
mg/día en el hombre y mayor a 750 mg/día en la mujer) puede ser causa de formación de cálculos, y se
puede deber a una ingesta excesiva de alimentos ricos en purinas o una sobreproducción endógena de
uratos.
Aproximadamente 15-20% de los pacientes con cálculos de Calcio tienen hiperuricosuria, esto se debe
a que el ácido úrico puede inducir la formación de cálculos de oxalato de Ca debido a que induce la
nucleación heterogénea.
También la hiperuricosuria puede asociarse con la hiperuricemia, más del 20% de los pacientes con
gota desarrollan cálculos de urato (la alcalinización de la orina reduce la formación de cálculos de úrico).
En el llamado síndrome de lisis tumoral que resulta en un rápido aumento de la concentración de ácido
úrico en sangre y en orina, puede llevar a una cristalización intratubular con obstrucción
desencadenando una insuficiencia renal aguda.
La formación de cálculos de AU es favorecida por ciertos factores: el pH ácido de la orina (a un pH
urinario <5.5 aproximadamente 100% está en forma de AU, a un pH urinario >6.5 la mayoría está como
urato), la hiperuricosuria, y disminución en la diuresis.
No siempre se presenta con hiperuricemia y puede presentarse en pacientes sin gota y sin
hiperuricosuria.
Múltiples estudios experimentales demostraron que el ácido úrico estimula la creación de ROS en varias
células, incluidas las células endoteliales, las células del músculo liso vascular (CMLV), los hepatocitos y
las células tubulares renales, cada una con una serie de repercusiones:
Ácido úrico y enfermedad cardiovascular:
Cada vez hay más evidencia que los sujetos con ácido úrico elevado, aparte de poder tener gota,
tienen MAYOR RIESGO CARDIOVASCULAR (NEJM 2008; 359: 1811-21) tanto en la población
aparentemente sana como en hipertensos (la hiperuricemia se detecta en el 25-40% de los pacientes
hipertensos sin tratamiento) (Ann Intern Med 1999; 131:7-13), más aún la hiperuricemia es también un
hallazgo muy frecuente en la insuficiencia cardíaca (Eur Heart J 1998; 19: 1814-1822), enfermedad
renal (Nephrol Dial Transplant 2004; 19: 457-462), infarto de miocardio, stroke (Stroke 2006; 37:
1503-1507), fibrilación auricular (Am J Transl Res 2018; 10: 2749-2763, y en el síndrome metabólico
(Diabetes Care 2000;23: 1835-1839); procesos en los que la DISFUNCION ENDOTELIAL
(Hypertension 1999; 34: 144-150) juega un papel fundamental en el desarrollo de sus complicaciones
14

de los pacientes con hiperuricemia, la misma se ha relacionado con la disfunción endotelial y la
proliferación de las CMLV (J Am Soc Nephrol 2002; 13: 2888-2897); la hiperuricemia incrementa un
16% la mortalidad por cualquier causa y un 39% por enfermedad cardiovascular.
Además se ha demostrado por estudios que el ácido úrico desencadena un proceso inflamatorio en
las CMLV con activación de las MAPK, NFkB, IL1β, TNF-α, IL-6- IL-18 y con aumento en la
expresión de la COX-2, MCP-1 y endotelina-1 (Hypertension 2003; 41: 1287-1293), activación de las
células endoteliales (Seminars in Nephrology 2005; 25: 39-42), activación e incremento en la
adhesividad plaquetaria (Clinica chimica Acta 2008; 392: 1-7), y sobreregula la expresión del factor
de crecimiento derivado de las plaquetas (Journal of Biological Chemistry 1991; 266: 8604-8608),
bloquea la síntesis de NO, y estimula la degradación de L-arginina (Med Sci Monit 2016; 22:
2501-2512).
Altos niveles de ácido úrico pueden promover la peroxidación lipídica (Am J Cardiol 1991; 68:
392-395), lo que conduce a un incremento en la adhesividad plaquetaria, resultando en la formación de
un trombo que contribuye al desarrollo de la aterosclerosis., también puede estimular la formación
de ROS lo que contribuye al daño del endotelio (Br J Clin Pharmacol 2000; 49:511), además la
hiperuricemia se correlaciona con inflamación crónica en la falla cardíaca crónica, además se asocia
con aumentos en los niveles de PCR (J Am Soc Nephrol 2005; 16: 3553-3562), proteína identificada
como un importante marcador de IAM, stroke y enfermedad cardiovascular.
Hiperuricemia e hipertensión
En la actualidad existe evidencia que vincula las concentraciones elevadas de AU con el desarrollo de la
hipertensión arterial (HTA), la observación de que ésta procede al surgimiento de la HTA, indica que
puede desempeñar papel patogénico potencial y que no es simplemente uno de los efectos de la HTA.
Numerosos estudios reportan que la hiperuricemia incrementa el riesgo relativo para desarrollar
hipertensión en los próximos 5 años, independientemente de otros factores, en los pacientes con
gota la hipertensión está presente entre el 25-50% de los casos.
Alrededor de un tercio de los pacientes hipertensos presentan hiperuricemia, en hipertensos y
diabéticos la asociación entre hiperuricemia y aparición de eventos cardiovasculares parece más nítida
que en la población general, el riesgo relativo se incrementa en forma directa con la concentración de
AU y es independiente de otros factores.
Con respecto a la hiperuricemia en la hipertensión es debido a varios factores: 1-bloquea la producción
de NO porque aumenta la producción de ROS lo que conduce a la fosforilación en el residuo Thr495 de
la NOS por la PKC, disminuyendo la interacción de la NOS con la Calmodulina; 2-disminuye la
fosforilación en el residuo Ser1177 por PI3K/Akt mediado por la insulina ya la hiperuricemia genera
resistencia la insulina, 3-estimula la síntesis de endotelina ya que está incrementada la vía de las MAP
kinasas, 4- disminuye la captación de arginina, 5-activa los canales de Na en el riñón aumentando su
reabsorción, 6-genera injuria endotelial, 7- disminuye la producción de adiponectina en el tejido adiposo,
8-activa al sistema renina angiotensina (Am J Transl Res 2018; 10: 2749-2763.
15
Este documento contiene más páginas...
Descargar Completo
acido urico 2020.pdf
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Descargar
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.