UNCo – Facultad de Ciencias Médicas
Introducción a la Química de los Sistemas Biológicos – 2021
Guía de estudio Nº 11: Enzimas
26
GUIA DE ESTUDIO Nº 11: Enzimas
I.- Conceptos básicos:
Cinética química: Concepto de velocidad de reacción, constantes cinéticas, influencia de la
temperatura. Catalizadores químicos y biológicos. Enzimas. Generalidades. Especificidad. Sitio
activo. Valoración de la actividad enzimática. Cinética enzimática. Velocidad inicial. Efecto de la
concentración de sustrato, temperatura, fuerza iónica, pH. Enzimas micaelianas. Km y velocidad
máxima. Enzimas alostéricas. Medición experimental de la actividad enzimática. Regulación
enzimática.
II.- Objetivos:
✓ Conocer las características más importantes de las enzimas y su modo de acción.
✓ Analizar el efecto de factores físicos, tales como la temperatura y pH sobre la velocidad de
acción de una enzima
✓ Comprender la influencia de activadores e inhibidores sobre la acción enzimática.
III.- Actividades
Actividad Nº 1.-Cinética química
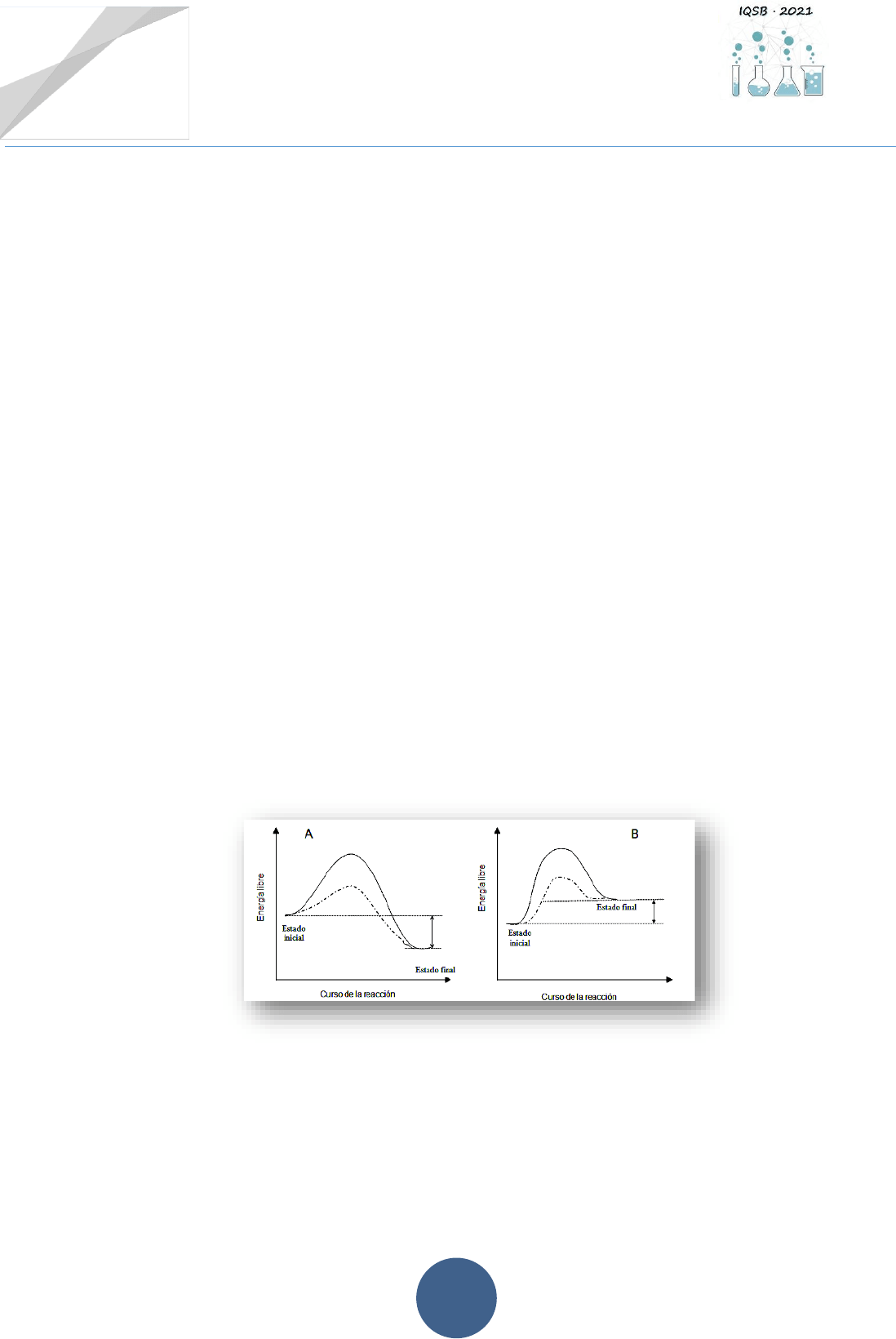
1.1.- En los siguientes gráficos se representan diagramas de energía libre para una reacción
espontánea y una no espontánea, en presencia y en ausencia de catalizador
a) Asignar a los siguientes ítems la representación que le corresponda en los gráficos:
i. Energía de activación de la reacción catalizada.
ii. Energía de activación de la reacción no catalizada.
iii. Variación de energía libre de la reacción con su signo correspondiente (+/-).
UNCo – Facultad de Ciencias Médicas
Introducción a la Química de los Sistemas Biológicos – 2021
Guía de estudio Nº 11: Enzimas
27
b) Tachar lo que no corresponda:
i. La curva A/ B representa una reacción espontánea debido a que la energía libre del
estado inicial es MAYOR/ MENOR que la del estado final. Por lo tanto, el signo de
G de la reacción será MAYOR/ MENOR que cero, y la reacción será
ENDERGÓNICA/ EXERGÓNICA.
ii. La diferencia de energía libre (G) global entre los reactivos y los productos es
IGUAL/ DIFERENTE en las reacciones catalizadas y no catalizadas.
iii. La constante de equilibrio de una reacción química NO VARÍA/ VARÍA con la
temperatura.
iv. La reacción catalizada por una enzima tiene lugar a una MAYOR/ MENOR velocidad
porque AUMENTA/ DISMINUYE la energía de activación.
v. Los catalizadores ALTERAN/ NO ALTERAN la posición de equilibrio de la reacción
que catalizan.
vi. Los catalizadores SUFREN/ NO SUFREN cambios en las transformaciones químicas
en las que participan y PUEDEN/ NO PUEDEN ser reutilizados.
1.2.- En cada caso, indicar si las afirmaciones son correctas o incorrectas, justificando brevemente:
a) Para cada reacción química hay una barrera energética que debe superarse para que la
reacción suceda.
b) El aumento de la energía cinética de los reactantes disminuye la velocidad de reacción.
c) Los catalizadores aumentan la velocidad en la cual la reacción alcanza el equilibrio al
aumentar la energía de activación.
1.3.-Señalar las principales diferencias entre un catalizador químico y un catalizador biológico.
Catalizador químico
Catalizador biológico
Condiciones de reacción
suaves
extremas
suaves
extremas
Velocidad de reacción
superior
inferior
superior
inferior
Especificidad
alta
baja
alta
baja
Regulación
si
no
si
no
Tipo de compuesto
inorgánico/orgánico
inorgánico/orgánico

UNCo – Facultad de Ciencias Médicas
Introducción a la Química de los Sistemas Biológicos – 2021
Guía de estudio Nº 11: Enzimas
28
Actividad Nº 2.-Enzimas.
2.1.- Nombrar las seis clases de enzimas e indicar mediante un ejemplo el tipo de reacción que
catalizan
2.2.- ¿Cuál de los siguientes enunciados, acerca de las reacciones catalizadas por enzimas, NO es
correcto?
a) Las enzimas forman complejos con sus sustratos.
b) Las enzimas disminuyen la energía de activación de las reacciones químicas
c) Las enzimas cambian la k de equilibrio de las reacciones químicas.
d) Muchas enzimas cambian de forma ligeramente cuando unen al sustrato.
e) Las reacciones ocurren en el centro activo de las enzimas, donde una orientación espacial
precisa de los aminoácidos es una cuestión muy importante para la catálisis.
2.3.-Consultar la bibliografía e indicar que tipo de coenzimas/cofactores utilizan las enzimas
teniendo en cuenta la clasificación citada anteriormente. Justifica con ejemplos.
Actividad Nº 3.-Cinética enzimática.
3.1-En base a los datos presentados en la Tabla graficar: V
0
(f) [S]
Tabla: Velocidades iniciales para una reacción enzimática
[S] (moles / litro)
V
0
(moles/min.)
1,5
5,2
2,5
7,3
5,0
11,3
15,0
17,0
40,83
17,5
44,00
17,5

UNCo – Facultad de Ciencias Médicas
Introducción a la Química de los Sistemas Biológicos – 2021
Guía de estudio Nº 11: Enzimas
29
3.2- Teniendo en cuenta el gráfico obtenido en la actividad 3.1.-, responder:
a) ¿Qué forma tiene la curva: hipérbola ó sigmoidea? ¿Qué ecuación matemática la
representa?
b) ¿Por qué se mantiene constante la velocidad a partir de la [S] de 9 M? ¿Cómo se denomina
este parámetro? Señalarlo en el grafico
c) Indicar de que orden es la reacción a [S] pequeñas y a [S] altas
d) ¿Cómo se podría incrementar nuevamente la velocidad?
e) ¿Cuál es la concentración de enzima libre a una [S] de 40,83 μM?
f) ¿A qué concentración de sustrato se logra la mitad de la velocidad máxima? ¿Cómo se
denomina este parámetro? Indicarlo en el grafico
g) ¿El Km es un valor fijo para cada enzima o puede variar según estructura del sustrato, la
temperatura y el pH?
h) Graficar la inversa de velocidad en función de la inversa de la concentración de sustrato,
indicando en el mismo Km y Vmáx (Lineweaver-Burk). Tener en cuenta el video en PEDCo
donde se explica el análisis matemático ó valerse de otras herramientas (Excel, por
ejemplo)
3.3.-Indicar si las siguientes afirmaciones son correctas o incorrectas, justificando en todos los
casos.
Una enzima que tiene dos sustratos, por los que presenta los siguientes valores:
Sustrato (S1) Km
1
= 5, 10
-6
M
Sustrato (S2) Km
2
= 5, 10
-9
M
a) presenta mayor afinidad por el S1
b) presenta mayor afinidad por el S2
c) presenta la misma afinidad para los dos sustratos
d) los valores de Km no se relacionan con la afinidad de la enzima por el sustrato
e) la velocidad máxima para S1 es igual a ½ de 5. 10
-6
M
UNCo – Facultad de Ciencias Médicas
Introducción a la Química de los Sistemas Biológicos – 2021
Guía de estudio Nº 11: Enzimas
30
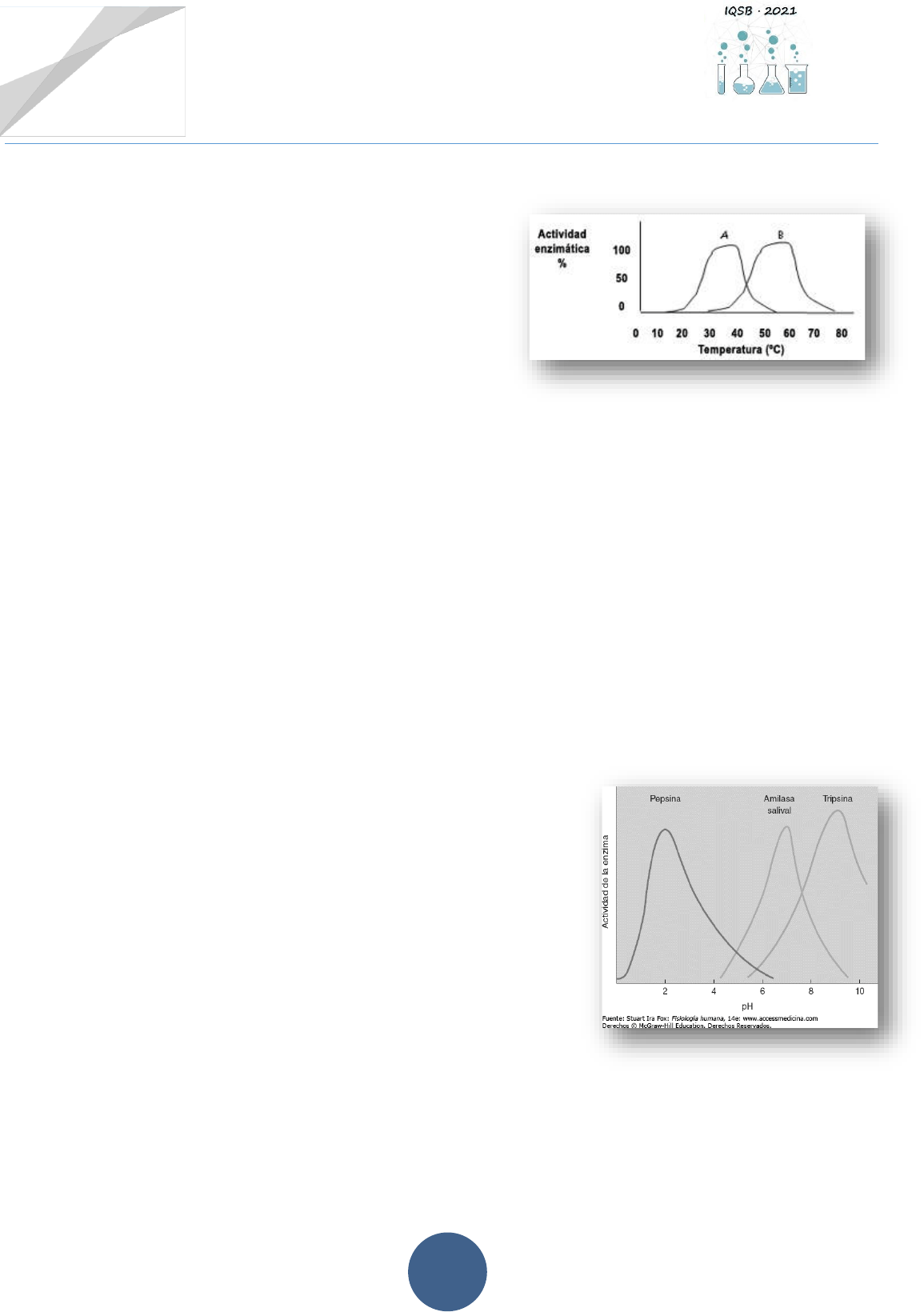
Actividad Nº 4.-Factores que modifican la actividad enzimática
4.1.-Las curvas que se muestran en el siguiente gráfico
representan la actividad de dos tipos diferentes de
enzimas.
a) ¿Cuál es la temperatura óptima de la enzima A?
¿Y la de la enzima B?
b) ¿A qué temperatura se interrumpe por
completo la actividad de cada una de estas enzimas?
c) Explicar cuáles son las causas de la variación en la actividad enzimática en temperaturas
inferiores a la óptima y en temperaturas superiores a ella.
d) ¿Qué indica la “cima” de cada curva?
e) Tomando en cuenta las temperaturas a las que actúan estas enzimas, ¿cuál de ellas podría
ser una enzima del cuerpo humano? Justificar brevemente la respuesta.
f) ¿Cuál de estas enzimas podría provenir de un organismo extremófilo? Justificar
brevemente la respuesta.
4.2.- En relación a las enzimas cuyas curvas de actividad se observan en el gráfico de la derecha:
a) Indicar pH óptimo de cada una de ellas.
b) Buscar en la bibliografía clasificación y función de cada
una de las enzimas presentadas.
c) Indicar de qué manera el pH puede afectar la actividad
enzimática.
d) Explicar de qué manera los seres vivos pueden mantener
estable el pH intracelular para que no se modifique la
actividad enzimática.
UNCo – Facultad de Ciencias Médicas
Introducción a la Química de los Sistemas Biológicos – 2021
Guía de estudio Nº 11: Enzimas
31
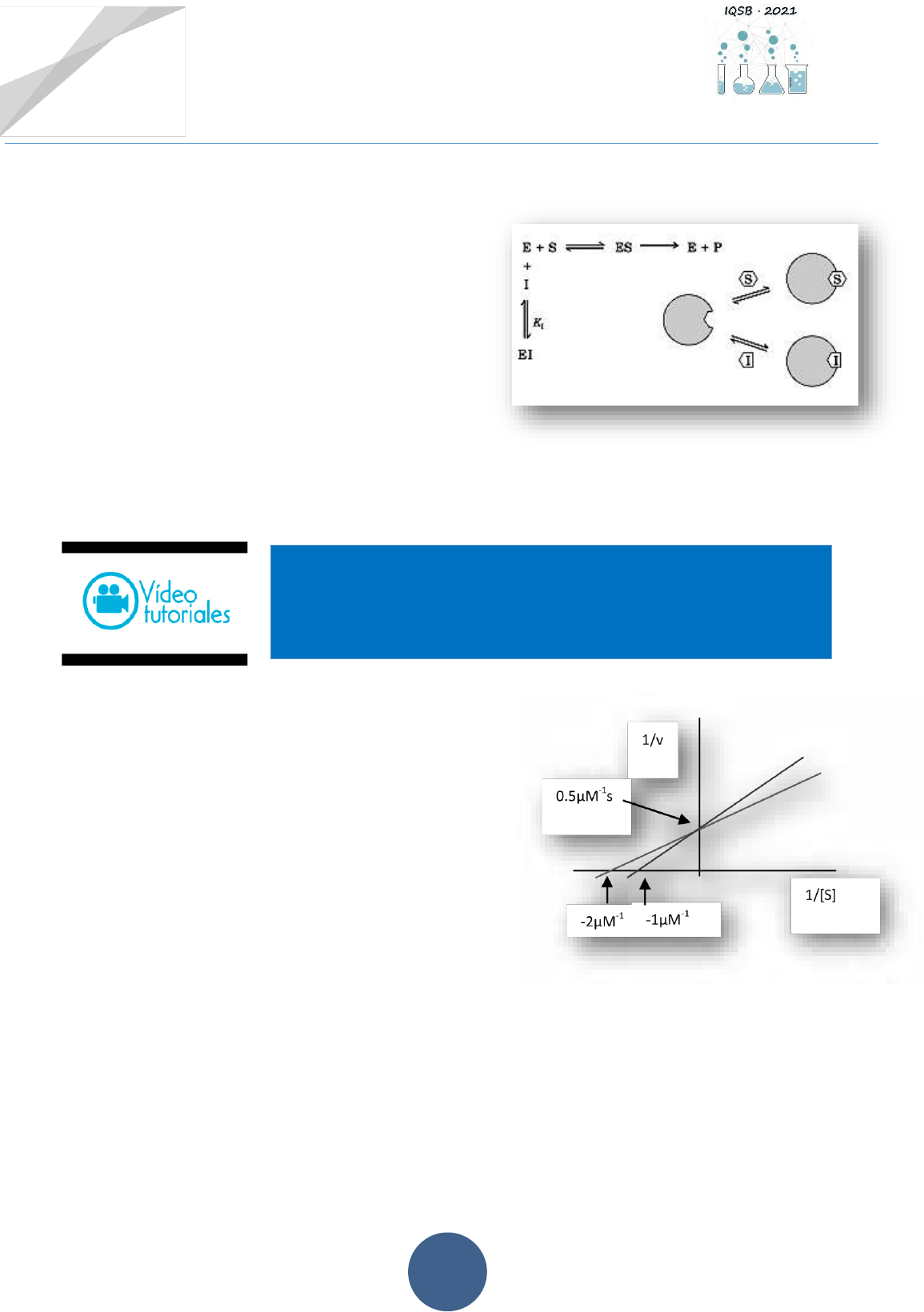
4.3.-La presencia de inhibidores afecta la actividad enzimática:
a) Describir el tipo de inhibición enzimática
propuesta en la imagen de la derecha:
b) Indicar si las misma es reversible o
irreversible. En caso de ser reversible, ¿de
qué forma se podrá revertir?
c) ¿Cómo sería el gráfico según Lineaweaver-
Burk para este tipo de inhibidor?
d) Si es posible, mencionar algún ejemplo de
este tipo de inhibición
4.4.- El ibuprofeno es una sustancia que ejerce su acción
antipirética y antiinflamatoria por un mecanismo de
inhibición competitiva sobre la enzima ciclooxigenasa.
Esta enzima cataliza la primera etapa de conversión del
ácido araquidónico en peróxidos cíclicos que darán lugar
a prostaglandinas y tromboxanos, mediadores de estos
procesos inflamatorios. Se ha realizado un ensayo para
estudiar los parámetros cinéticos de esta enzima en
presencia y en ausencia de ibuprofeno y se han obtenido los datos que se reflejan en el gráfico de
la derecha.
a) ¿Podría este gráfico reflejar los parámetros cinéticos de la ciclooxigenasa en presencia y
ausencia de ibuprofeno?
b) Señalar: ¿cuál de las rectas corresponde al ensayo en presencia de inhibidor?
c) Calcular Vmáx, Km y Km aparente.
Antes de comenzar a resolver la siguiente actividad
ingresa a PEDCo y accede al video tutorial
elaborado por la cátedra
INORGÁNICOS
UNCo – Facultad de Ciencias Médicas
Introducción a la Química de los Sistemas Biológicos – 2021
Guía de estudio Nº 11: Enzimas
32
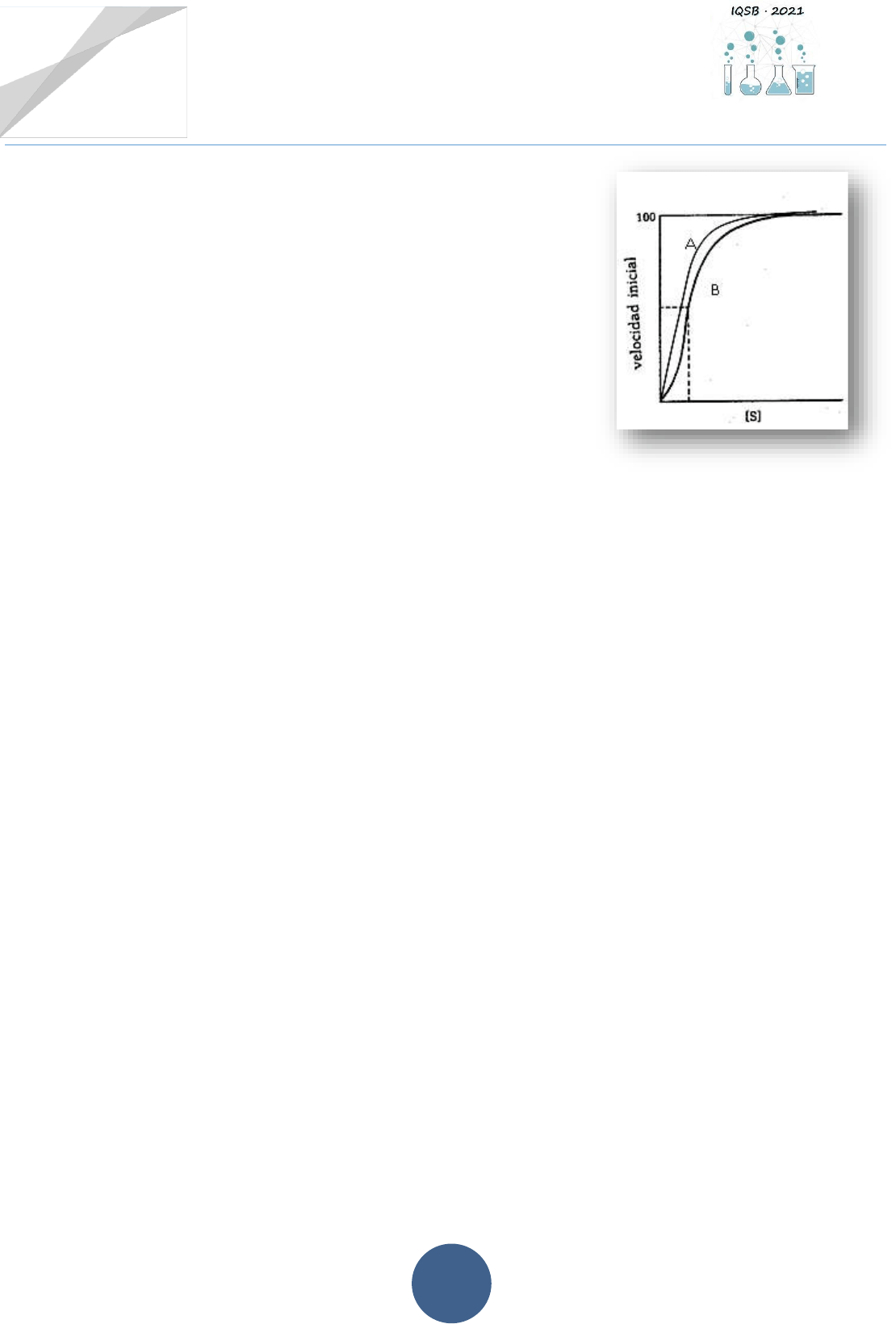
Actividad 5.-Enzimas alostéricas
5.1.-Dado el gráfico de la derecha:
a) Indicar qué tipo de enzima (micaeliana o alostérica)
representa cada una de las curvas.
b) En cada frase colocar curva A o curva B, según
corresponda:
✓ No tiene la forma de una hipérbola rectangular sino
sigmoidal. __________
✓ A bajas [S] la velocidad de reacción aumenta de forma
relativamente lenta, mientras que, a concentraciones de S aproximadamente igual a
Km, la velocidad crece menos rápidamente que lo que sugiere la ecuación de Michaelis-
Menten. __________
✓ La unión de las primeras moléculas de sustrato a la enzima no varía la afinidad de las
mismas por las subsiguientes moléculas de sustrato. __________
5.2.- Explicar, teniendo en cuenta la curva de actividad enzimática presentada en la actividad 5.1.-
cuál es la diferencia estructural entre las enzimas alostéricas y micaelianas.
5.3.-Indicar si las siguientes afirmaciones son correctas o incorrectas, justificando en todos los
casos:
a) Los reguladores alostéricos se unen al sitio activo de la enzima.
b) Un regulador alostérico posee una forma similar al sustrato.
c) Para todas las enzimas alostéricas, la unión del regulador alostérico induce un cambio
conformacional en la enzima.
d) Una enzima con comportamiento alostérico puede, en algunas condiciones, comportarse
según la ecuación de Michaelis-Menten.
e) Las enzimas cooperativas tienen dos conformaciones en equilibrio, y una de ellas posee
mayor afinidad por el sustrato.

UNCo – Facultad de Ciencias Médicas
Introducción a la Química de los Sistemas Biológicos – 2021
Guía de estudio Nº 11: Enzimas
33
5.4.- En la ruta de la glucólisis existen tres pasos importantes de regulación alostérica, catalizados
por la hexoquinasa, la fosfofructoquinasa-1 y la piruvatoquinasa. Indicar que reacción catalizan y
cuáles son los moduladores positivos y negativos de cada una de las enzimas mencionadas.
Actividad 6.-Regulación enzimática
6.1.-Existen enzimas que pasan de una forma menos activa a otra más activa uniéndose
covalentemente a un grupo químico de pequeño tamaño como el P
i
o el AMP. También se da el
caso inverso, en el que una enzima muy activa se desactiva al liberar algún grupo químico. En las
enzimas de las vías degradativas del metabolismo, la forma fosforilada es más activa que la no
fosforilada, mientras que en las vías biosintéticas ocurre lo contrario.
a) Buscar en la bibliografía ejemplos de modificaciones covalentes por fosforilación.
b) Nombrar otros mecanismos de modificación covalente.
6.2.-Algunas enzimas no se sintetizan como tales, sino como proteínas precursoras sin actividad
enzimática. Estas proteínas se llaman pro enzimas o zimógenos. Para activarse, los zimógenos
sufren un ataque hidrolítico que origina la liberación de uno o varios péptidos. Es el caso de la a-
quimotripsina, que se sintetiza en forma de quimotripsinógeno. Así, la tripsina pancreática (una
proteasa) se sintetiza como tripsinógeno (inactivo). Si por alguna razón se activa en el propio
páncreas, la glándula sufre un proceso de autodestrucción (pancreatitis aguda), a menudo mortal.
Buscar en la bibliografía otros ejemplos de enzimas que sufran modificaciones covalentes
irreversibles.
Actividad 7: Aplicación clínica del estudio cualitativo y cuantitativo de enzimas. Isoenzimas.
Las enzimas presentes en suero que actúan sobre el mismo sustrato fisiológico, pero
corresponden a isoformas diferentes, fueron descubiertas aplicando técnicas electroforéticas.
Buscar en la bibliografía qué tipo de enzima es LDH y cuáles son su ISOZIMAS ó ISOENZIMAS y su
aplicación en el diagnóstico de infarto agudo de miocardio.
Resolvemos la Actividad de Simulación propuesta en PEDCo y la
trabajamos en el FORO

2021 GUIA DE ESTUDIO Nº 11 ENZIMAS (1).pdf
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Descargar
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.