
Citoesqueleto
Resistencia del mecanismo:
se debe a la
matriz extracelular y al citoesqueleto.
Citoesqueleto: se encuentra dentro de la
célula y está compuesto por un conjunto de
filamentos de actina (microfilamentos),
microtúbulos y filamentos intermedios.
Puede controlar el dinamismo.
• Filamentos de actina: se extienden por todo
el citoplasma de la célula formando una
corteza debajo de la membrana. Está formada
por una proteína globular que es la actina G y
esta molécula tiene una hendidura en el que
se inserta un nucleótido de ATP o ADP.
Las actina G forman un filamento por dos
cadenas unidas en hélice y se mueven en un
medio hasta formar un núcleo con tres
moléculas de actina G, y se forma el polímero.
- Etapa nucleación: la actina libre forma un
núcleo de 3 actinas G para formar un polímero
- Elongación: se elonga el filamento por los
extremos, se agregan filamentos de actina G.
- Estado estacionario: las moléculas que
entran y abandonan el polímero están en eq.
en ambos extremos. Hay polimerización y
despolarización al mismo tiempo, pero no
crecimiento neto, ya que es la misma cantidad
la que entra que la que sale.
En esta etapa, la concentración de actina G
alcanza la concentración crítica de actina
soluble no polarizada.
Filamento decorado con miosina: en su
estructura forma flechas indicando la dirección
en la que se mueve. En este caso se mueve
hacia la izquierda que es (-).
Si el crecimiento por el extremo (-) es menor
que el extremo (+), las moléculas se agregan
por el extremo (+). Hay una asimetría, el
filamento no es igual en ambos extremos.
Los extremos pueden ser tapados por
proteínas, teniendo distintas concentraciones
críticas, polimerización y despolarización del
extremo libre. Hay estadio estacionario.
Pero esto es regulado. En la célula hay
varias proteínas como la profilina, ciclo de la
timosina y la cofilina que regulan el proceso.
• Profilina: captura moléculas de actina G
unidas al ADP. Por un cambio conformacional
en la molécula de actina, el ADP se deprende
y es sustituido por un ATP. Acelerando el
intercambio de actina ADP a actina ATP.
• Cofilina: capta moléculas de actina unidas
al ADP por lo que continuamente está bajando
la concentración del citosol, desplazando el
eq. a la despolarización.
La timosina se une con gran afinidad a las
moléculas de actina de ATP que pueden
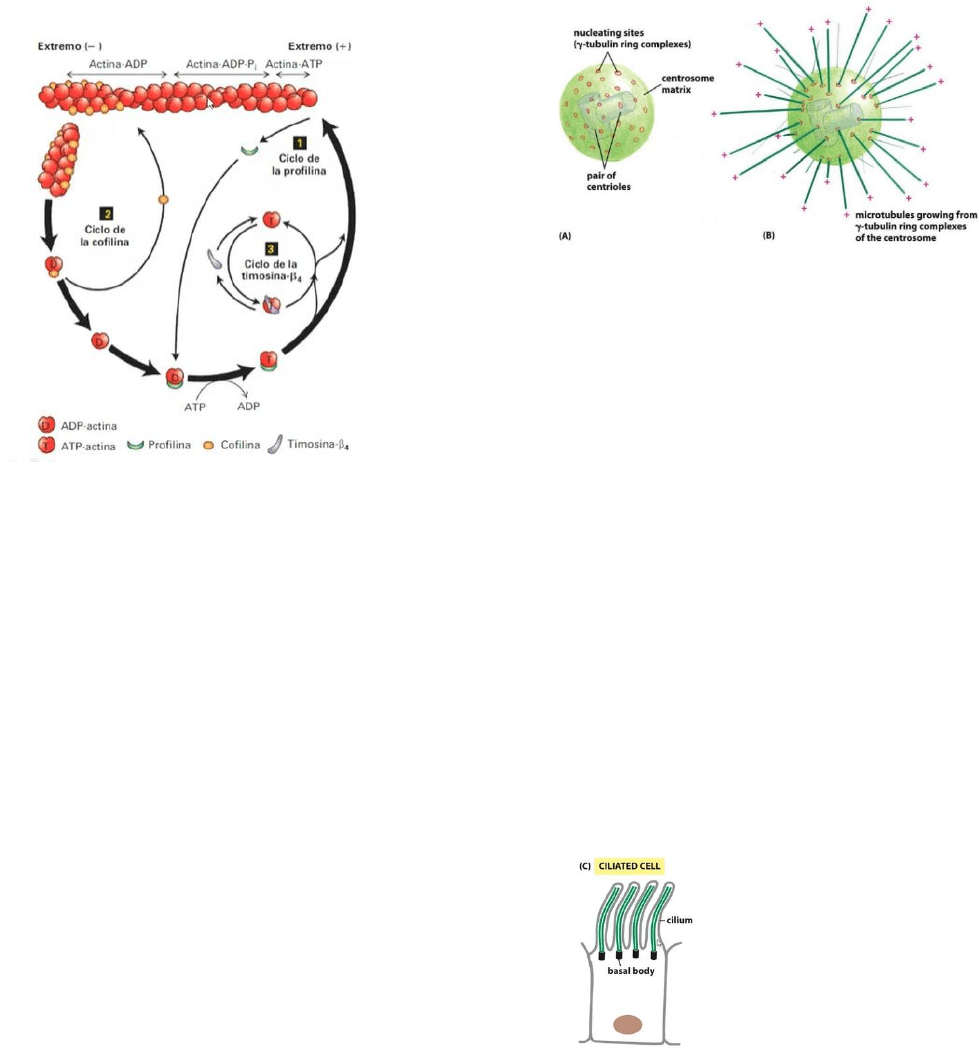
formar parte del extremo (+) o pueden ser
capturadas por la timosina.
Hay una alta concentración de actina por
encima de la concentración crítica, pero no
hay crecimiento por que las células están
atrapadas por la timosina. Si se quiere tener
una polimerización rápida, el eq. se desplaza
y las moléculas deja de estar unidas a la
timosina para formar parte del polímero.
Hay proteínas, como las CapZ que pueden
tapar los extremos bloqueando la entrada y
salida de subunidades. Esto regula el
crecimiento de los polímeros.
Otras proteínas asociadas a la actina
median entre filamentos para que tomen
diferentes formas, todas las formas se dan por
la interacción de la actina asociada a
proteínas.
Microtúbulos: son estructuras alargadas y
huecas, son polímeros. Hay un centro que es
organizador en donde emergen y se extienden
todos los microtúbulos formando una
compleja red en el citoplasma.
Se estudian en la interfase de la mitosis. En
esta etapa toda la red se desarma y los
componentes cambian formando el huso
mitótico.
Las unidades de los microtúbulos son
heterodímeros, formado por dos moléculas
globulares de tubulina α y β conformando
dímeros.
Los heterodímeros forman protofilamentos
dejando una luz central, creando la estructura
microtubular.
En el centro organizar de microtúbulos hay
centriolos y una nube proteica difusa
alrededor. Dicho centro, alberga los extremos
(-) de los microtúbulos, mientras que los
extremos (+) están hacia afuera.
Cuando los extremos (+) están libres
pueden ganar o perder unidades. Si ganan
unidades los microtúbulos crecen o si pierden
reducen su tamaño.
El extremo (+) incorpora las moléculas de
tubulina que tienen GTP. El GTP es el
nucleótido que las activa para la
polimerización. Estas pasan a ser parte del
extremo (+), polimerizando. Luego el GTP se
hidroliza y pasa a ser GDP teniendo menos
afinidad.
Cuando se detiene el proceso, la hidrolisis
alcanza el extremo y el microtúbulo comienza
a despolimerizarse produciendo un
acortamiento. Por lo que los microtúbulos van
creciendo y decreciendo de manera continua.
Si los extremos (+) localizan las proteínas
que sellan estos extremos, detienen el
crecimiento y decrecimiento
constante. Los microtúbulos
logran crecer de manera
continua y estable.
Células ciliadas: hay un
centro organizador de microtúbulo
(centrosoma) en el que salen los microtúbulos,
formando la estructura de la célula.
En la base de cada cilia hay otro centro
organizador del cuerpo basal en el que se

organizan los microtúbulos estables formando
el citoesqueleto de las cilias.
En las células ciliadas los microtúbulos
están en dobletes (uno es incompleto y otro
completo) y en el medio hay un par central. A
esto se le llama axonema.
Síndrome de Kartagener: inmoviliza los
cilios, esto sucede cuando las estructuras
ciliadas son casi irreconocibles. Provoca
cambios en diferentes órganos como la
posición. Los cilios se encargan de mantener
toda la geometría.
Proteínas motoras: la asimetría de las
actinas es la base para la movilidad de las
proteínas motoras.
Tipos:
• Miosina: se asocia con la actina.
• Kinesinas y dineínas: se asocian con los
microtúbulos.
Estas proteínas tienen cabeza globulares
que se unen a un elemento del citoesqueleto,
en este caso a un microtúbulo.
Son ATPasas, se hidroliza ATP, cambiando
de conformación y mientras que una de las
cabezas esta unida, la otra se desplaza. Hay
algunas que se desplazan hacia el extremo (-
) como las dineínas, mientras que las
kinesinas se desplazan hacia el extremo (+).
Las miosinas no se asocian con los
microtúbulos, sino que se asocian con los
filamentos de actina.
Hay colas que contienen carga por lo que el
desplazamiento es a través de un dispositivo
que permite transportar cargas desde el
extremo (-) hacia el (+).
Los microtúbulos organizar la forma y
polaridad celular. Participan en la movilidad
celular, movimiento internos, en el huso
mitótico y el batido ciliar, pueden
Filamentos intermedios: no participan en
desplazamiento o movimiento celular, ni se
asocia a proteínas motoras. No se fijan a
nucleótidos
Son estables, no tienen inestabilidad
dinámica ni asimetría, es decir que no tienen
extremo (+) o (-).
Subunidades filamentosas (bastones α-
helicoidales).
Tamaño intermedio, por eso su nombre.
No necesita la hidrólisis de ATP ni de GTP
para estabilizar el polímero.
Proteínas: se clasifican en clases y cada una
es específica.
• Clase I, II: proteínas de la familia de la
keratina y ocurre en células epiteliales.
• Clase III: son de la familia de vimentina o
relacionada a ella. Tejido conectivo, muscular,
células de la glía.
• Clase IV: proteínas de neurofilamentos y
están en células nerviosas.
• Clase V: estas proteínas forman filamentos
en el núcleo y son láminas nucleares. Están
presentes en todas las células animales.
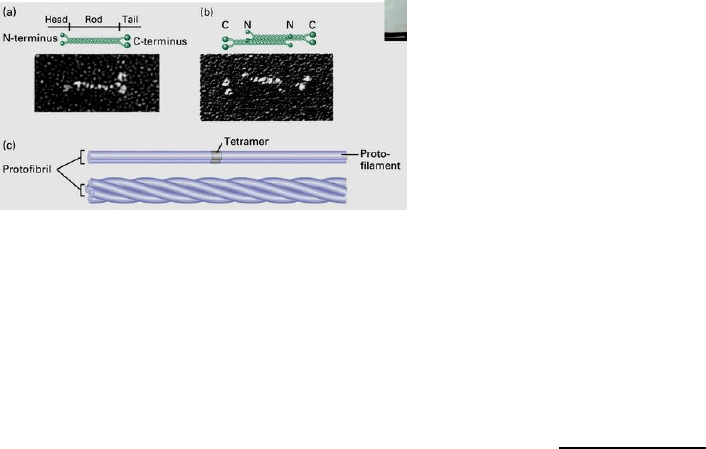
Estructura: no presentan forma globular, sino
que son hepatocitos que tiene un extremo
amino terminal y otro carboxilo terminal
paralelos.
Los dímeros forman tetrámeros que se
organizan de forma antiparalela, es decir, el
extrema amino y carboxilo se cambian. Se
coloca la cabeza con cola para formar otro
filamentos que interacciona con otros
lateralmente y se unen formando una hélice
compleja. Tienen una fuerte atracción y
resistencia estos filamentos.
Cuando una célula entra en mitosis, las
proteínas se fosforilan e incorporan grupos
fosfatos por acción de proteínas quinasas, y
las láminas se fosforilan. Al fosforilarse las
láminas, sueltan la malla (láminas nucleares)
desapareciendo la envoltura nuclear.
La envoltura nuclear se transforma o pasa a
formar parte del sistema del retículo
endoplasmático. Los cromosomas quedan en
el material cromosómico y se organizan
nuevamente los pronúcleos organizándose el
sistema de membrana cuando se desfosforila.
Por más que estas estructuras sean muy
resistentes, se pueden desfosforila o fosforila
por cambios químicos en la célula.
Adhesión celular y complejos de unión: en
un complejo de unión dos células o
estructuras microscópicas se unen y forman
una estructura permanente. Es una
estructura.
• Unión adherente: dos células se unen
fuertemente entre sí, o las células se unen a
la lámina basal. Se da por las cadherinas.
Interaccionan con los filamentos de actina y
los filamentos intermedios.
• Uniones oclusivas: forman un sello entre
las células endoteliales formando dos
compartimientos a ambos lados de la célula.
Interviene las ocludinas
Las uniones ocluyentes atraen moléculas
de señalización diversas hacia la superficie
celular y las vinculan con los filamentos de
actina del citoesqueleto.
• Unión por canales o unión de hendidura:
forman canales de comunicación entre las
células por enlaces gap. Esto permite de que
se transmitir desde el citoplasma de una célula
a otra sin pasar por el espacio extracelular.
Hay difusión rápida de moléculas pequeñas
solubles en agua entre el citoplasma de
células adyacentes. Intervienen las
conexinas.
• Unión de anclaje a la matriz extracelular:
dan resistencia mecánica. Las proteínas que
permiten el anclaje a la matriz extracelular son
las integrinas.
Proteínas del complejo de unión:
Cadherinas: son proteínas importantes en la
adhesión intercelular y señalización celular.
Forman complejos de unión estables.
Las cadherinas junto con los filamentos de
actina forman desmosoma de banda. Mientras
que si se unen las cadherinas con filamentos
intermedios forman la unión de desmosoma.
Ocludinas: proteína que forma parte de las
hebras en las zonas de oclusión entre células
epiteliales.
Conexinas: proteínas estructurales
transmembranales que se unen para formar
enlaces gap.
Integrinas: son una gran familia de proteínas
heterodiméricas αβ que median la adhesiones
entre células y entre célula y matriz.

2 - Citoesqueleto.pdf
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Descargar
 Estamos procesando este archivo...
Estamos procesando este archivo...
 Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.
Lamentablemente la previsualización de este archivo no está disponible. De todas maneras puedes descargarlo y ver si te es útil.